题目内容
1. 将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )
将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )| A. | 投入的Na、K的质量一定相等 | |
| B. | 投入的Na的质量小于K的质量 | |
| C. | 曲线A表示Na与盐酸反应,曲线B表示K与盐酸反应 | |
| D. | 该实验能证明K的金属性小于Na的金属性 |
分析 从所给出的图象可知,钠、钾与分别与盐酸反应生成氢气的质量相等,两金属的物质的量相同;钾活泼性强于钠,所以K与氢离子反应剧烈、速率大,故生成等质量氢气所需时间短,据此分析解答.
解答 解:A.由图可知,二者生成氢气的质量相等,钠、钾都是碱金属,与酸反应都生成+1价阳离子,所以参加反应的两金属的物质的量相同,钾的摩尔质量大于钠,所以需钾的质量要大,故A错误;
B.产生相同量的氢气,消耗钠、钾的物质的量相同,钾的摩尔质量大于钠,所以需钾的质量要大,故B正确;
C.钾活泼性强于钠,所以K与氢离子反应剧烈、速率大,故生成等质量氢气所需时间短,故C错误;
D.该实验能证明K的金属性大于Na的金属性,故D错误;
故选:B.
点评 本题考查了金属的化学性质,明确图象含义、金属活动顺序及有关计算是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.可以把6种无色液体:乙醇、苯酚、CCl4、AgNO3溶液、KOH溶液、氢硫酸区分开的试剂是( )
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
9.在下列各溶液中,离子一定能大量共存的是( )
| A. | 能使紫色石蕊试液变红的溶液中:Fe2+、Na+、SO42-、NO3- | |
| B. | 碱性溶液中:Na+、K+、NO3-、ClO- | |
| C. | pH=1的溶液中:Na+、Cu2+、Cl-、S2- | |
| D. | 加入Al能放出氢气的溶液中:NH4+、SO42-、NO3-、ClO- |
6.下列说法正确的是( )
| A. | 有机物中都存在同分异构现象 | |
| B. | 只要含有的官能团种类相同就是同系物 | |
| C. | 14C和14Si是同位素 | |
| D. | C2H5Cl没有同分异构体 |
13.一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g)═pC(g)达到平衡后,维持温度不变,将气体体积缩小到原来的$\frac{1}{2}$,当达到新的平衡后,气体C的浓度为原平衡的1.9倍.则下列说的正确的是( )
| A. | m+n<p | B. | 平衡向正反应方向移动 | ||
| C. | m+n>p | D. | C的质量分数增加 |
1.聚合硫酸铁(PFS)是一种重要的无机高分子絮凝剂,在工业和生活污水处理等领域具有重要应用.PFS可表示成Fex(OH)y(SO4)z(其中铁元素化合价为+3),工业上常用绿矾等原料制备,采用“一锅法”制备PFS的工艺流程如下.
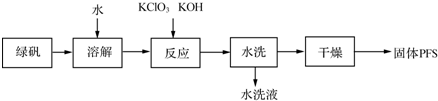
(1)从上述流程判断,水洗液中可以回收的主要物质有KCl、K2SO4.
(2)绿矾溶液与KClO3、KOH发生反应,其中还原剂与氧化剂的物质的量之比为6:1.
(3)下表是PFS的三种生产工艺所使用的原料.
试分析“一锅法”工艺的优点是未使用硫酸,不腐蚀设备,选择表中的一种方案分析其可能的缺点双氧水法:反应放热,双氧水分解(或次氯酸钠法:产生氯气,污染环境或硝酸氧化法:产生NO2等氮氧化物污染环境).
(4)在PFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=$\frac{n(O{H}^{-})}{3n(Fe)}$×100%,式中n(OH-)、n(Fe)分别表示聚合硫酸铁中OH-和Fe的物质的量.取7.51g某聚合硫酸铁溶解于稀盐酸,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48g;再向上述滤液中加入足量NH3•H2O,经过滤、洗涤、干燥、灼烧得Fe2O3固体2.80g.试计算该固体聚合硫酸铁的盐基度.

(1)从上述流程判断,水洗液中可以回收的主要物质有KCl、K2SO4.
(2)绿矾溶液与KClO3、KOH发生反应,其中还原剂与氧化剂的物质的量之比为6:1.
(3)下表是PFS的三种生产工艺所使用的原料.
| 方法 | 双氧水氧化法 | 次氯酸钠氧化法 | 硝酸氧化法 |
| 原料 | 绿矾、硫酸、双氧水 | 绿矾、硫酸、次氯酸钠 | 绿矾、硫酸、浓硝酸等 |
(4)在PFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=$\frac{n(O{H}^{-})}{3n(Fe)}$×100%,式中n(OH-)、n(Fe)分别表示聚合硫酸铁中OH-和Fe的物质的量.取7.51g某聚合硫酸铁溶解于稀盐酸,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48g;再向上述滤液中加入足量NH3•H2O,经过滤、洗涤、干燥、灼烧得Fe2O3固体2.80g.试计算该固体聚合硫酸铁的盐基度.
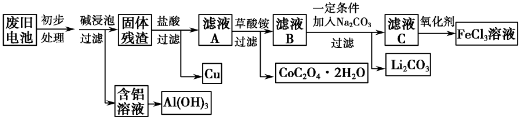
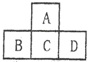 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答: ,.
,.