题目内容
4.下列各组离子浓度在指定溶液中一定能大量共存的是( )①加入铝能放出H2的溶液中:Al3+、Fe2+、Cl-、NO3-、S2-
②使pH=11的溶液中:Na+、NO3-、SO32-、AlO2-、S2-
③由水电离出的c(H+)=10-12mol/L的溶液中:Na+、NO3-、SO32-、AlO2-、S2-
④能使淀粉碘化钾试纸显蓝色的溶液:K+、SO32-、SO42-、S2-、OH-
⑤使甲基橙变红的溶液中:Fe3+、NH4+、Cl-、K+、SO42-.
| A. | ③④ | B. | ②④ | C. | ②⑤ | D. | ①⑤ |
分析 ①加入Al能放出H2的溶液为酸或强碱溶液,硝酸根离子在酸性条件下能够氧化亚铁离子、硫离子;碱性溶液中,铝离子和亚铁离子与氢氧根离子反应;
②pH=11的溶液,显碱性,5种离子之间不反应,都不与氢氧根离子反应;
③由水电离的c(H+)=10-12mol•L-1的溶液为酸或碱溶液,酸性条件下硝酸根离子能够氧化亚硫酸根离子、硫离子,偏铝酸根离子与氢离子反应;
④能使淀粉碘化钾试纸显蓝色的溶液具有氧化性,亚硫酸根离子、硫离子容易被氧化;
⑤使甲基橙变红的溶液为酸性溶液,溶液中存在大量氢离子,5种离子之间不反应,都不与氢离子反应.
解答 解:①加入铝能放出H2的溶液为酸性或强碱性溶液,Al3+、Fe2+与氢氧根离子反应,酸性溶液中NO3-能够氧化S2-、Fe2+,在溶液中不能大量共存,故①错误;
②使pH=11的溶液中存在大量氢氧根离子,Na+、NO3-、SO32-、AlO2-、S2-离子之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故②正确;
③由水电离出的c(H+)=10-12mol/L的溶液中存在大量氢离子或氢氧根离子,酸性溶液中NO3-能够氧化SO32-、S2-,AlO2-、与氢离子反应,在溶液中不能大量共存,故③错误;
④能使淀粉碘化钾试纸显蓝色的溶液具有强氧化性,能够氧化SO32-、S2-,在溶液中不能大量共存,故④错误;
⑤使甲基橙变红的溶液为酸性溶液,Fe3+、NH4+、Cl-、K+、SO42-之间不反应,都不与酸性溶液中的氢离子反应,在溶液中能够大量共存,故⑤正确;
故选C.
点评 本题考查了离子共存的判断,题目难度中等,明确离子反应发生条件及题干暗含条件的含义为解答关键,注意掌握离子能够共存的条件,试题侧重考查学生的分析、理解能力及逻辑推理能力.

练习册系列答案
相关题目
20.下列物质的分类错误的是( )
| A. | 水、二氧化硫和干冰都属氧化物 | B. | H2SO4、HNO3和H2CO3都属于酸 | ||
| C. | KNO3、CuSO4和NH4Cl都属于盐 | D. | 烧碱、纯碱、熟石灰都属于碱 |
1.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 2.4g Mg与N2完全反应,转移电子数都是0.3NA | |
| B. | 1mol白磷分子中含有P-P键数为1.5NA | |
| C. | 1.7gH2O2中含有的电子数为0.9NA | |
| D. | 在18g 18O2中含有2NA个氧原子 |
5.下列说法错误的是( )
| A. | 84g NaHCO3 溶于1L水配得1mol•L-1 NaHCO3 溶液 | |
| B. | 在标准状况下,44.8L HCl溶于1L水配成2mol•L-1 的盐酸溶液 | |
| C. | 在标准状况下,22.4L NH3溶于水配成1L溶液,浓度为1mol•L-1 | |
| D. | 1mol•L-1 的CaCl2溶液溶液1L,取出100mL,含0.2mol Cl- |
9.下列说法正确的是( )
| A. | 强电解质在稀溶液中全部以离子的形式存在 | |
| B. | 常温下,电解质溶液的pH都在0~14之间 | |
| C. | 强电解质的水溶液导电性一定比弱电解质水溶液导电性强 | |
| D. | 弱电解质在水溶液中溶解度都很小 |
16.下列说法正确的是( )
| A. | NaHCO3 是强电解质,BaCO3 是弱电解质 | |
| B. | c(H+)=1×10-7mol•L-1的溶液一定呈中性 | |
| C. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| D. | 将0.05 mol•L-1醋酸溶液加水稀释时,c(H+)变小 |
13.2014年5月7日南京某建设公司丢失用于材料探伤的放射源${\;}_{77}^{192}$Ir一枚,Ir是第Ⅷ族元素,下列关于${\;}_{77}^{192}$Ir的说法正确的是( )
| A. | ${\;}_{77}^{192}$Ir核外含有115个电子 | B. | Ir为非金属元素 | ||
| C. | ${\;}_{77}^{192}$Ir的中子数是115 | D. | ${\;}_{77}^{192}$Ir的质量数是77 |
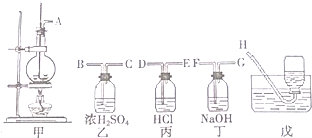
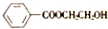 )和N(
)和N(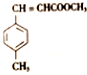 )
)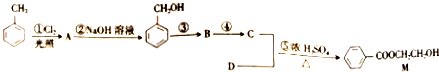
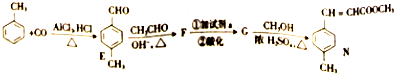
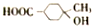 )是E经多步反应的产物,与R共有相同官能团且官能团都直接连在六元环上,则满足上述条件R的共同异构体还有18种(不考虑立体异构).
)是E经多步反应的产物,与R共有相同官能团且官能团都直接连在六元环上,则满足上述条件R的共同异构体还有18种(不考虑立体异构).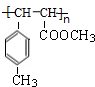 .
.