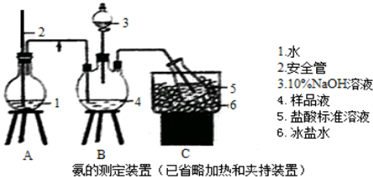
题目内容
1.几种短周期元素的原子半径及主要化合价如下表:| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A. | X、Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以和Z的氢化物反应 |
分析 W的化合价只有-2价,故W为氧元素;Z具有-3、+5价,原子半径大于氧元素且相差不大,故Z为氮元素;X只有+2价,Y只有+3价,X、Y原子半径相差不大,原子半径较氮元素、氧元素大很多,可知X、Y位于第三周期相邻主族,故X为镁元素,Y为铝元素.结合元素周期律与物质性质解答.
解答 解:W的化合价只有-2价,故W为氧元素;Z具有-3、+5价,原子半径大于氧元素且相差不大,故Z为氮元素;X只有+2价,Y只有+3价,X、Y原子半径相差不大,原子半径较氮元素、氧元素大很多,可知X、Y位于第三周期相邻主族,故X为镁元素,Y为铝元素,
A.X为镁元素,Y为铝元素,同周期自左而右,金属性减弱,故金属性X>Y,故A错误;
B.W为氧元素、Z为氮元素,两者的单质一定条件下直接生成NO,故B错误;
C.Y是Al,Al的最高价氧化物的水化物是氢氧化铝,氢氧化铝是两性氢氧化物,溶于强酸强碱,不溶于弱酸弱碱,氢氧化铝不溶于氨水,故C错误;
D.一定条件下,氧气可以和氨气反应生成水和NO,故D正确.
故选D.
点评 本题考查了结构与元素周期律知识,难度中等,学生能利用原子半径及化合价来推断出元素是解答本题的关键,并熟悉元素及其单质、化合物的性质来解答即可.

练习册系列答案
相关题目
17.下列叙述不正确的是( )
| A. | CH3COOH与C6H5COOH为同系物 | |
| B. | 戊烷比丙烷的沸点高 | |
| C. | 烷烃的化学性质与甲烷类似,通常较稳定 | |
| D. | 用燃烧法可鉴别甲烷和乙烯 |
9.下列说法正确的是( )
| A. | 强电解质在稀溶液中全部以离子的形式存在 | |
| B. | 常温下,电解质溶液的pH都在0~14之间 | |
| C. | 强电解质的水溶液导电性一定比弱电解质水溶液导电性强 | |
| D. | 弱电解质在水溶液中溶解度都很小 |
16.下列说法正确的是( )
| A. | NaHCO3 是强电解质,BaCO3 是弱电解质 | |
| B. | c(H+)=1×10-7mol•L-1的溶液一定呈中性 | |
| C. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| D. | 将0.05 mol•L-1醋酸溶液加水稀释时,c(H+)变小 |
13.2014年5月7日南京某建设公司丢失用于材料探伤的放射源${\;}_{77}^{192}$Ir一枚,Ir是第Ⅷ族元素,下列关于${\;}_{77}^{192}$Ir的说法正确的是( )
| A. | ${\;}_{77}^{192}$Ir核外含有115个电子 | B. | Ir为非金属元素 | ||
| C. | ${\;}_{77}^{192}$Ir的中子数是115 | D. | ${\;}_{77}^{192}$Ir的质量数是77 |
11.下列递变规律正确的是( )
| A. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| B. | P、S、Cl最高正价依次降低 | |
| C. | HCl、HBr、HI的稳定性依次增强 | |
| D. | 钠、镁、铝的金属性依次减弱 |
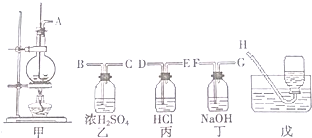
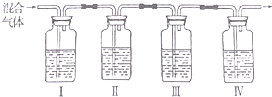
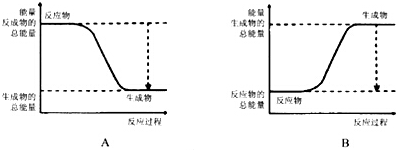 根据化学反应与能量转化的相关知识,试回答下列问题:
根据化学反应与能量转化的相关知识,试回答下列问题: