题目内容
8.某单烯烃与H2加成后的产物是: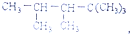 ,则该烯烃的结构式可能有( )
,则该烯烃的结构式可能有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 2种 |
分析 加成反应指有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应.根据加成原理采取逆推法还原C=C双键,烷烃分子中相邻碳原子上均带氢原子的碳原子间是对应烯烃存在碳碳双键的位置.还原双键时注意:先判断该烃结构是否对称,如果对称,只考虑该分子一边的结构和对称线两边相邻碳原子即可;如果不对称,要全部考虑,然后各去掉相邻碳原子上的一个氢原子形成双键.
解答 解:根据烯烃与H2加成反应的原理,推知该烷烃分子中相邻碳原子上均带氢原子的碳原子间是对应烯烃存在碳碳双键的位置.该烷烃的碳链结构为 ,1号和6号碳原子关于2号碳原子对称,5、8、9号碳原子关于4号碳原子对称,但4号碳原子上没有氢原子,所以4号碳原子和3、5、8、9号碳原子间不能形成双键;相邻碳原子之间各去掉1个氢原子形成双键,所以能形成双键有:1和2之间(或2和6);2和3之间;3和7之间,共有3种,
,1号和6号碳原子关于2号碳原子对称,5、8、9号碳原子关于4号碳原子对称,但4号碳原子上没有氢原子,所以4号碳原子和3、5、8、9号碳原子间不能形成双键;相邻碳原子之间各去掉1个氢原子形成双键,所以能形成双键有:1和2之间(或2和6);2和3之间;3和7之间,共有3种,
故选A.
点评 本题以加成反应为载体,考查同分异构体的书写,理解加成反应原理是解题的关键,采取逆推法还原C=C双键,注意分析分子结构是否对称,防止重写、漏写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是( )
| A. | 以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-═4OH- | |
| B. | 以NaOH溶液为电解液时,负极区域的现象:先生成白色沉淀后逐渐溶解 | |
| C. | 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 | |
| D. | 电池工作时,电子通过外电路从正极流向负极 |
5.下列说法错误的是( )
| A. | 84g NaHCO3 溶于1L水配得1mol•L-1 NaHCO3 溶液 | |
| B. | 在标准状况下,44.8L HCl溶于1L水配成2mol•L-1 的盐酸溶液 | |
| C. | 在标准状况下,22.4L NH3溶于水配成1L溶液,浓度为1mol•L-1 | |
| D. | 1mol•L-1 的CaCl2溶液溶液1L,取出100mL,含0.2mol Cl- |
16.下列说法正确的是( )
| A. | NaHCO3 是强电解质,BaCO3 是弱电解质 | |
| B. | c(H+)=1×10-7mol•L-1的溶液一定呈中性 | |
| C. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| D. | 将0.05 mol•L-1醋酸溶液加水稀释时,c(H+)变小 |
3.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,46gCH4中含有的分子数为NA | |
| B. | 通常状况下,14gCO含有的电子数目为7NA | |
| C. | lL0.2mol•L-1的CH3COOH溶液中,H+数目为0.2NA | |
| D. | 0.1molCu与400mLlmol•L-1稀硝酸反应后,溶液中的NO3数目为为0.2NA |
13.2014年5月7日南京某建设公司丢失用于材料探伤的放射源${\;}_{77}^{192}$Ir一枚,Ir是第Ⅷ族元素,下列关于${\;}_{77}^{192}$Ir的说法正确的是( )
| A. | ${\;}_{77}^{192}$Ir核外含有115个电子 | B. | Ir为非金属元素 | ||
| C. | ${\;}_{77}^{192}$Ir的中子数是115 | D. | ${\;}_{77}^{192}$Ir的质量数是77 |
20.已知1mol氢气完全燃烧生成水蒸气时放出242kJ的能量,且氧气中1mol O═O键完全断裂时需要吸收496kJ的能量,水蒸气中1mol H-O键形成时放出463kJ的能量,则氢气中1mol H-H键断裂时吸收的能量为( )
| A. | 436 kJ | B. | 557 kJ | C. | 920 kJ | D. | 181 kJ |
17.下列叙述正确的是( )
| A. | 淀粉与纤维素互为同分异构体 | |
| B. | 工业上以石油为原料生产乙烯 | |
| C. | 油脂不是酯 | |
| D. | 充分燃烧后只生成CO2和H2O的有机物就是烃 |
18.下列说法正确的是( )
| A. | 分子晶体中都存在共价键 | B. | 在单质的晶体中一定不存在阴离子 | ||
| C. | 离子晶体中只有离子键 | D. | 干冰和冰中作用力完全相同 |