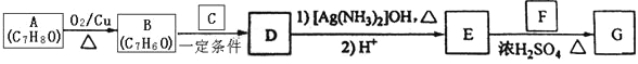题目内容
【题目】硫化锌 (ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如下图所示。

(1)为提高锌灰的浸取率,可采用的方法是 (填序号)。
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是 (写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为____________。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是 ;
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取。化学反应方程式为________;
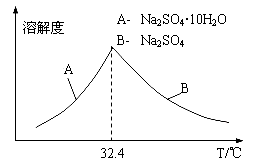
③已知Na2SO4·10H2O及Na2SO4的溶解度随温度变化曲线如图。从滤液中得到Na2SO4·10H2O的操作方法是 。
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为c mol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为____________。
【答案】27.(15分)(1)①②③⑤; (2) Fe(OH)3、ZnCO3 ; (3)Zn(或锌) ;
(4)①取最后的洗涤液少许于试管,滴加几滴BaCl2溶液,若出现浑浊则未洗净,反之则已洗净;
②Na2SO4+CH4![]() Na2S+2H2O+CO2 ; ③蒸发浓缩,降温结晶,过滤 ;
Na2S+2H2O+CO2 ; ③蒸发浓缩,降温结晶,过滤 ;
(5)65(Vc-b-d)g。
【解析】
试题分析:(1)该过程是在溶液中进行的化学反应,加快化学反应速率的方法有升高温度,增大接触面积等,所以为提高锌灰的浸取率,可采用的方法是①研磨、②多次浸取、③升高温度、⑤搅拌,答案为①②③⑤。
(2)锌灰浸取液中有Zn2+、Cd2+、Fe2+、Fe3+,加入H2O2后,H2O2将Fe2+氧化成Fe3+,再加入过量的ZnCO3,ZnCO3消耗了溶液中的氢离子,ZnCO3+2H+=Zn2++CO2↑+H2O,导致平衡Fe3++3H2O![]() Fe(OH)3+3H+,向右移动,生成Fe(OH)3沉淀,所以步骤Ⅱ所得滤渣中的物质是ZnCO3和Fe(OH)3。
Fe(OH)3+3H+,向右移动,生成Fe(OH)3沉淀,所以步骤Ⅱ所得滤渣中的物质是ZnCO3和Fe(OH)3。
(3)根据化学反应Zn+Cd2+=Zn2++Cd,步骤Ⅲ中加入试剂b可得Cd单质,为避免引入新的杂质,试剂b应为Zn(或锌)。
(4)①ZnS固体上粘有的离子有SO42-,只要检验SO42-是否存在即可,方法是取最后的洗涤液少许于试管,滴加几滴BaCl2溶液,若出现浑浊则未洗净,反之则已洗净;
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取,根据题意,反应的化学方程式为Na2SO4+CH4![]() Na2S+2H2O+CO2;
Na2S+2H2O+CO2;
③根据溶解度—温度曲线可知,从滤液中得到Na2SO4·10H2O的操作方法是蒸发浓缩,降温结晶,过滤。
(5)根据化学反应ZnSO4+Na2S=ZnS↓+Na2SO4,Zn+Cd2+=Zn2++Cd,ZnCO3+2H+=Zn2++CO2↑+H2O,所以若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为c mol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为65(Vc-b-d)g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案