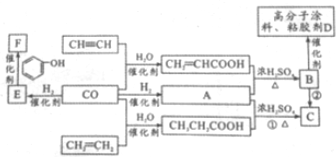
题目内容
8. 利用硫酸工业尾气中的二氧化硫可以制取氮肥硫酸铵.某探究小组设计实验对制得硫酸铵的品质进行鉴定.
利用硫酸工业尾气中的二氧化硫可以制取氮肥硫酸铵.某探究小组设计实验对制得硫酸铵的品质进行鉴定.【查阅资料】硫酸铵化肥品质的束腰指标如表:
| 指标 项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
实验一:气体法测定含氮量.(实验装置如图1所示)
(1)烧瓶内发生反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;烧杯中盛放的试剂最好是稀硫酸(填“浓硫酸”、“稀硫酸”或“水”)
(2)甲同认为根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:A、B装置间缺一个干燥装置.针对甲同学指出的缺陷,他们改进了实验装置,重新进行实验,准确测得氢气的质量.
实验二:甲醛法测定含氮量.
已知:①甲醛结构简式为HCHO,在空气中易被氧化成甲酸,甲酸酸性比乙醛强.
②甲醛法的反应原理为:4NH4++6HCHO→4H++6H2O+(CH2)6N4生成的酸再用NaOH标准溶液滴定,从而测定氮的含量.
(1)实验步骤:称取固体(NH4)2SO4样品0.600g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液,用②(填图2中仪器编号)滴定管准确取出20.00mL的溶液与锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴指示剂(已知滴定终点的pH约为8.8),用浓度为0.1000mol•L-1 NaOH标准溶液滴定,读数如表:
| 滴定次数 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 1.20 | 18.91 |
| 2 | 0.00 | 18.60 |
| 3 | 1.10 | 18.79 |
(3)若滴定前待测也加甲醛后露置空气时间过长,则所测定的含氮量比实际值偏大(填“偏大”“偏小”或“无影响”).
实验三:测定碳酸氢铵中的含氮量
碳酸氢铵也是常用的氮肥,如果测定其含氮量,应选择的方法是气体法(填“气体法”或“甲醛法”),不选择另一种方法的理由是甲醛法用氢氧化钠标准溶液滴定时,溶液中HCO3-中的H+也会和氢氧化钠中和.
分析 实验一:(1)铵根离子与碱反应生成氨气和水,氨气是碱性气体,需酸吸收;
(2)制取氨气为固体和液体反应,所以制取的气体中含有水蒸气应除去;
实验二:
(1)固体(NH4)2SO4样品溶于水溶液中铵根离子水解显酸性,应在酸式滴定管中量取;
(2)依据图表数据计算0.600g样品中硫酸铵的质量计算含氮量判断级别,氢氧化钠溶于滴定所消耗的体积应取1,3,2组实验测定结果误差太大舍去,依据1,3计算体积消耗的平均值,甲醛法的反应原理为:4NH4++6HCHO→4H++6H2O+(CH2)6N4生成的酸再用NaOH标准溶液滴定,从而测定氮的含量;
(3)若滴定前待测也加甲醛露置空气时间过长在空气中易被氧化成甲酸,消耗的氢氧化钠量会增大;
实验三:
碳酸氢钠和氢氧根离子反应生成碳酸根离子和水.
解答 解:实验一:
(1)硫酸铵和氢氧化钠反应生成硫酸钠、水和氨气,反应方程式为:(NH4)2SO4+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2NH3↑+2H2O,离子反应为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,烧杯中盛放的试剂是用来吸收氨气的,所以用稀硫酸,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;稀硫酸;
(2)制取氨气为氢氧化钠溶液与硫酸铵固体反应,所以生成的氨气中含有水蒸气,随氨气一同进入B装置中,影响氨气的质量,影响含氮量的测定,所以需增加一个干燥装置;
故答案为:A、B装置间缺一个干燥装置;
实验二:
(1)固体(NH4)2SO4样品溶于水溶液中铵根离子水解显酸性,应在酸式滴定管中量取,图中选择仪器②,故答案为:②;
(2)氢氧化钠溶于滴定所消耗的体积应取1,3组数据,2组实验测定结果误差太大舍去,依据1,3计算体积消耗的平均值=$\frac{18.91-1.2+18.79-1.1}{2}$=17.7ml,甲醛法的反应原理为:4NH4++6HCHO→4H++6H2O+(CH2)6N4生成的酸再用NaOH标准溶液滴定:
4NH4+~2(NH4)2SO4~4H+~4NaOH
4 4
n 0.02L×0.1000mol•L-1
n=0.002mol
100ml溶液中含有铵根离子物质的量=0.002mol×$\frac{100}{20}$=0.01mol
依据图表数据计算0.600g样品中硫酸铵的质量计算含氮量=$\frac{0.01mol×14g/mol}{0.60g}$×100%=23.3%≥21.0%,属于一等品;
故答案为:是;
(3)若滴定前待测也加甲醛后露置空气时间过长,甲醛露置空气时间过长在空气中易被氧化成甲酸,消耗的氢氧化钠量会增大,测定含氮量偏大;
故答案为:偏大;
实验三:甲醛法中,需要用氢氧化钠滴定,因为氢氧化钠和碳酸氢根离子反应生成氢氧化钠反应,所以会导致测量结果偏大,所以测定其含氮量,应选择的方法是气体法;
故答案为:气体法;甲醛法用氢氧化钠标准溶液滴定时,溶液中HCO3-中的H+也会和氢氧化钠中和.
点评 本题考查了物质含量的测定,明确实验原理是解本题关键,根据物质间的反应结合实验操作进行解答,此种类型的题阅读量较大,同时考查书写获取信息、加工信息的能力,注意取用的溶液为配制溶液的五分之一,不是全部溶液,为易错点,题目难度中等.

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案| A. | 原子半径Z>W>Y>X | |
| B. | 气态氢化物的稳定性Z>W | |
| C. | Y的最高价氧化物对应的水化物可与其气态氢化物发生化合反应 | |
| D. | X的气态氢化物与足量W单质在光照条件下反应所得生成物均为气体 |
| A. | 1mol Na2O和Na2O2的混合物中,阴阳离子总数为3NA | |
| B. | 非标准状况下,NA个CO2分子所占的条件不可能为22.4L | |
| C. | 24.4gNa2O•SiO2中含有0.2NA个SiO2分子 | |
| D. | 56gFe投入1000mL3.5mol•L-1稀硝酸中,充分反应,转移电子总数为3NA |
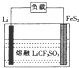 Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )| A. | Li为电池的正极 | |
| B. | 电池工作时,Li+向负极移动 | |
| C. | 正极的电极反应式为FeS2+4e-=Fe+2S2- | |
| D. | 将熔融的LiCF2SO4改为LiCl的水溶液,电池能更好 |
| A. | 是银白色质软的金属 | B. | 能形成+3价的化合物 | ||
| C. | Tl(OH)3一定是两性氢氧化物 | D. | 单质铊的还原性一定比单质铝强 |
| A. | 常温常压,11.2 L NO和O2混合气体的原子数为NA | |
| B. | 1.5 g甲基所含有的电子数目为0.9NA | |
| C. | 1 L 0.1mol/L的氨水中含有的N原子数小于0.1NA | |
| D. | 7.8g苯中碳碳双键的数目为0.3NA |
| A. | 葡萄糖、麦芽糖均能与银氨溶液反应 | |
| B. | 甘氨酸和丙氨酸缩合最多可以形成四种二肽 | |
| C. | 富含蛋白质的豆浆煮沸后即可得人体所需的氨基酸 | |
| D. | 油酯在氢氧化钾溶液中水解可制得汽车洗涤用的液体肥皂 |