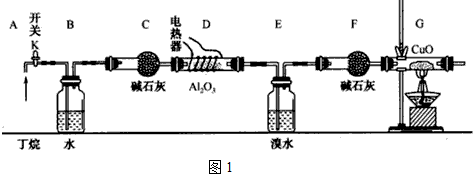
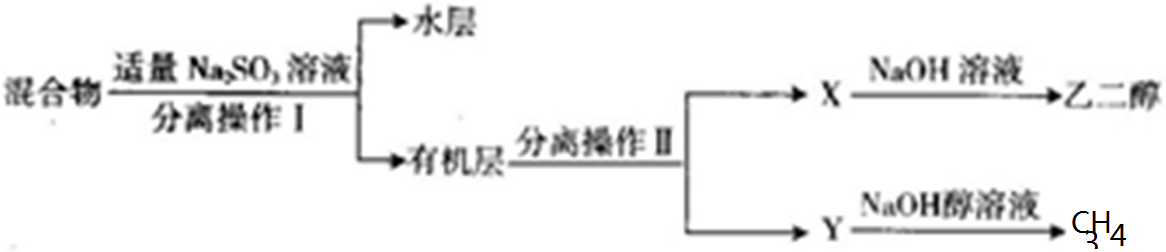
题目内容
13.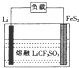 Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )| A. | Li为电池的正极 | |
| B. | 电池工作时,Li+向负极移动 | |
| C. | 正极的电极反应式为FeS2+4e-=Fe+2S2- | |
| D. | 将熔融的LiCF2SO4改为LiCl的水溶液,电池能更好 |
分析 根据电池反应式知,放电时Li失电子发生氧化反应,则Li是负极,电极反应式为Li-e-=Li+,FeS2为正极,正极反应式为FeS2+4e-=Fe+2S2-,放电时电解质中阳离子向正极移动、阴离子向负极移动,据此分析解答.
解答 解:根据电池反应式知,放电时Li失电子发生氧化反应,则Li是负极,电极反应式为Li-e-=Li+,FeS2为正极,正极反应式为FeS2+4e-=Fe+2S2-,
A.通过以上分析知,Li为电池负极,发生氧化反应,故A错误;
B.放电时,阳离子Li+向正极移动,故B错误;
C.FeS2为正极,正极反应式为FeS2+4e-=Fe+2S2-,故C正确;
D.将熔融的LiCF2SO4改为LiCl的水溶液,Li和水发生氧化还原反应生成氢气,所以不能将熔融的LiCF2SO4改为LiCl的水溶液,故D错误;
故选C.
点评 本题考查化学电源新型电池,为高考高频点,明确原电池中元素化合价变化与电极正负极关系,难点是电极反应式的书写,题目难度中等.

练习册系列答案
相关题目
3.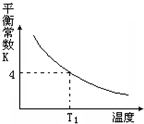 T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )
T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )
 T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )
T℃时,将1molX和2molY投入2L的密闭容器中,发生反应X(g)+Y(g)?2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图.则下列判断正确的是( )| 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
| X | 1 | 0.80 | 0.66 | 0.58 | 0.52 | 0.50 | 0.50 |
| Y | 2 | 1.80 | 1.66 | … | … | … | … |
| A. | 前5min用Z表示的平均反应速率为0.2 mol/(L•min) | |
| B. | 该反应的正反应是吸热反应,且T1>T | |
| C. | 若温度为T1时,以同样的起始量反应,达到平衡时X的转化率约为66.7% | |
| D. | 在T℃时,以1molX、2molY和1molZ充入上述容器中,达到平衡时,X的转化率仍为50% |
4.一种高容量的固态锂电池以锂超离子固态导体(组成为Li30GeP2S12)为电解质,该锂电池能在-100℃至100℃之间的超宽温度范围内工作.下列说法不正确的是( )
| A. | Li的原子结构示意图为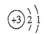 | B. | 原子半径:P>S | ||
| C. | 酸性:H3PO4<H2SO4 | D. | Li、Ge、P、S都属于短周期元素 |
1.下列有关化学用语的各种表示正确的是( )
| A. | 电子式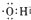 可以表示烃基,也可以表示氢氧根离子 可以表示烃基,也可以表示氢氧根离子 | |
| B. | 磷原子的简化电子排布式:[He]3s23p3 | |
| C. | 聚丙烯链节的结构简式为:-CH2-CH-CH2- | |
| D. | 用惰性电极电解MgCl2溶液的离子方程式为:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+Mg(OH)2↓ |
8. 利用硫酸工业尾气中的二氧化硫可以制取氮肥硫酸铵.某探究小组设计实验对制得硫酸铵的品质进行鉴定.
利用硫酸工业尾气中的二氧化硫可以制取氮肥硫酸铵.某探究小组设计实验对制得硫酸铵的品质进行鉴定.
【查阅资料】硫酸铵化肥品质的束腰指标如表:
【观察外观】该硫酸铵化肥无可见机械杂质.
实验一:气体法测定含氮量.(实验装置如图1所示)
(1)烧瓶内发生反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;烧杯中盛放的试剂最好是稀硫酸(填“浓硫酸”、“稀硫酸”或“水”)
(2)甲同认为根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:A、B装置间缺一个干燥装置.针对甲同学指出的缺陷,他们改进了实验装置,重新进行实验,准确测得氢气的质量.
实验二:甲醛法测定含氮量.
已知:①甲醛结构简式为HCHO,在空气中易被氧化成甲酸,甲酸酸性比乙醛强.
②甲醛法的反应原理为:4NH4++6HCHO→4H++6H2O+(CH2)6N4生成的酸再用NaOH标准溶液滴定,从而测定氮的含量.
(1)实验步骤:称取固体(NH4)2SO4样品0.600g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液,用②(填图2中仪器编号)滴定管准确取出20.00mL的溶液与锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴指示剂(已知滴定终点的pH约为8.8),用浓度为0.1000mol•L-1 NaOH标准溶液滴定,读数如表:
(2)探究结论,该化肥是(填“是”或“不是”)一等品.
(3)若滴定前待测也加甲醛后露置空气时间过长,则所测定的含氮量比实际值偏大(填“偏大”“偏小”或“无影响”).
实验三:测定碳酸氢铵中的含氮量
碳酸氢铵也是常用的氮肥,如果测定其含氮量,应选择的方法是气体法(填“气体法”或“甲醛法”),不选择另一种方法的理由是甲醛法用氢氧化钠标准溶液滴定时,溶液中HCO3-中的H+也会和氢氧化钠中和.
 利用硫酸工业尾气中的二氧化硫可以制取氮肥硫酸铵.某探究小组设计实验对制得硫酸铵的品质进行鉴定.
利用硫酸工业尾气中的二氧化硫可以制取氮肥硫酸铵.某探究小组设计实验对制得硫酸铵的品质进行鉴定.【查阅资料】硫酸铵化肥品质的束腰指标如表:
| 指标 项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
实验一:气体法测定含氮量.(实验装置如图1所示)
(1)烧瓶内发生反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;烧杯中盛放的试剂最好是稀硫酸(填“浓硫酸”、“稀硫酸”或“水”)
(2)甲同认为根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:A、B装置间缺一个干燥装置.针对甲同学指出的缺陷,他们改进了实验装置,重新进行实验,准确测得氢气的质量.
实验二:甲醛法测定含氮量.
已知:①甲醛结构简式为HCHO,在空气中易被氧化成甲酸,甲酸酸性比乙醛强.
②甲醛法的反应原理为:4NH4++6HCHO→4H++6H2O+(CH2)6N4生成的酸再用NaOH标准溶液滴定,从而测定氮的含量.
(1)实验步骤:称取固体(NH4)2SO4样品0.600g于烧杯中,加入约30mL蒸馏水溶解,最终配成100mL溶液,用②(填图2中仪器编号)滴定管准确取出20.00mL的溶液与锥形瓶中,加入18%中性甲醛溶液5mL,放置5min后,加入1~2滴指示剂(已知滴定终点的pH约为8.8),用浓度为0.1000mol•L-1 NaOH标准溶液滴定,读数如表:
| 滴定次数 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 1.20 | 18.91 |
| 2 | 0.00 | 18.60 |
| 3 | 1.10 | 18.79 |
(3)若滴定前待测也加甲醛后露置空气时间过长,则所测定的含氮量比实际值偏大(填“偏大”“偏小”或“无影响”).
实验三:测定碳酸氢铵中的含氮量
碳酸氢铵也是常用的氮肥,如果测定其含氮量,应选择的方法是气体法(填“气体法”或“甲醛法”),不选择另一种方法的理由是甲醛法用氢氧化钠标准溶液滴定时,溶液中HCO3-中的H+也会和氢氧化钠中和.
5.一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )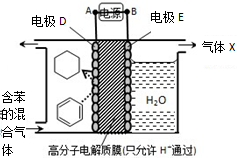

| A. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 | |
| B. | 气体X在反应中通常体现还原性 | |
| C. | 电极D为惰性电极,E为活泼电极 | |
| D. | 外电路电子的移动方向:A→电极→B |
2.背景材料:
①浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③中科大最近成功发现了一种新的铁基超导材料 (Li0.8Fe0.2)OHFeSe(Se呈-2价).
④瑞典皇家理工学院(KTH)的研究人员已经成功的构建出了一种能使水快速氧化成氧气的分子催化剂.
下列说法不正确的是( )
①浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③中科大最近成功发现了一种新的铁基超导材料 (Li0.8Fe0.2)OHFeSe(Se呈-2价).
④瑞典皇家理工学院(KTH)的研究人员已经成功的构建出了一种能使水快速氧化成氧气的分子催化剂.
下列说法不正确的是( )
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 新的铁基超导材料中Fe的化合价呈+2、+3价 | |
| D. | 该分子催化剂可将一次能源太阳能直接转化成二次能源 |
3.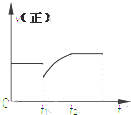 某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
 某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )
某密闭容器中的反应:3H2(g)+N2$?_{△}^{催化剂}$2NH3(g)△H<0,其正反应速率随时间变化的情况如图所示,判断下列有关t1时刻条件变化的说法可能正确的是( )| A. | 增大NH3浓度的同时减小N2浓度 | B. | 增大N2和H2的浓度 | ||
| C. | 扩大容器的体积 | D. | 降低反应温度 |