题目内容
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族,A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素名称:A_______B________C________D_______E______
(2)用电子式表示离子化合物A2B的形成过程:_____________________
(3)写出下列物质的化学式、电子式或结构式:
①D元素形成的单质的结构式___________
②E和B形成化合物的电子式___________、___________
③A、B、E形成的化合物的化学式为________
④D、E形成的化合物空间结构型为________形_________性分子
⑤D、C、E形成的化合物的化学式为____________
⑥D、E形成的化合物为______化合物,(填“离子”或“共价”)包含的化学键为______________。
【答案】钠 氧 硫 氮 氢 ![]() N≡N
N≡N ![]()
![]() NaOH 正四面体 极 (NH4)2S 离子 离子键、非极性共价键
NaOH 正四面体 极 (NH4)2S 离子 离子键、非极性共价键
【解析】
五种短周期元素的原子序数的大小顺序为C>A>B>D>E.A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30,则离子含有的电子数为10,由A2B可知,A离子为+1价离子,B离子为-2价离子,则A为钠元素,B为氧元素;B、C同主族,则C为硫元素;D和E可形成四核10电子分子,则D为氮元素,E为氢元素。故A为钠元素,B为氧元素,C为硫元素,D为氮元素,E为氢元素。
(1)由上述分析可知,A为钠元素;B为氧元素;C为硫元素, D为氮元素,E为氢元素,故答案为钠,氧,硫,氮,氢;
(2)A2B是Na2O,该物质是离子化合物,用电子式表示A2B的形成过程是![]() ,故答案为
,故答案为![]() ;
;
(3) ①D元素是N元素,其单质是N2,两个N原子共用三对电子,结构式是N≡N,故答案为N≡N;
②E和B形成化合物是H2O、H2O2,其电子式分别是![]() 、
、![]() ,故答案为
,故答案为![]() 、
、![]() ;
;
③A、B、E形成的化合物的化学式为NaOH,故答案为NaOH;
④D、E形成的化合物为NH3,空间结构型为正四面体形,极性分子,故答案为正四面体,极;
⑤D、C、E形成的化合物的化学式为(NH4)2S,故答案为(NH4)2S;
⑥A、B两元素组成的化合物A2B2是Na2O2,该物质属于离子化合物,其中含有离子键、非极性共价键,故答案为离子,离子键、非极性共价键。

【题目】分别取40mL的0.50mol·L-1盐酸与40mL的0.55mol·L-1NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式__。
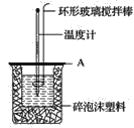
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是__。
(3)假设盐酸和NaOH溶液的密度都是1g·cm-3,又知中和后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,实验时还需测量的数据有(填字母)__。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前NaOH溶液的温度
D.反应前NaOH溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH | ||
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__。