题目内容
某研究性学习小组采用温和水溶液法,以CuCl2·2H2O和H2C2O4·2H2O为原料合成新颖结构的草酸铜晶体。为进一步探究草酸铜晶体的性质,现将草酸铜晶体在一定条件下加热分解,对所得气体产物和红色固体产物进行实验和研究。
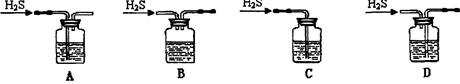
Ⅰ、用以下装置检验气体产物的成分。
(1)C装置的作用是检验 ,D装置的作用是检验 。(用化学式回答)
(2)用PdCl2溶液检验CO时发生反应的化学方程式为______________________________;
(3)D、E两装置位置能否互换?为什么?_____________________________________。
(4)若需测定气体产物的含量,则A装置能很好地降低实验误差,在实验中,至少有____次使用到A装置,分别起什么作用?_____________________________。
Ⅱ、对固体产物的成分进行探究
①提出合理假设:
假设1:红色固体为Cu ;
假设2:红色固体为Cu2O ;
假设3: 。
②设计实验方案证明你的假设(不要在答题卡上作答)
③实验过程
根据②中方案进行实验在答题卡上按下表的格式写出实验步骤、预期现象与结论。
| 实验步骤 | 预期现象与结论 |
| 步骤1: | |
| 步骤2: | |
| …… | |
Ⅰ、(1)H2O(1分)、CO2 (1分)
(2) PdCl2 + CO + H2O = Pd↓ + CO2 + 2HCl (方程式书写完整2分)
(3)不能,若互换则E装置中可能产生的CO2对D装置中CO2的检验造成干扰。(其他合理答案也可,2分)
(4)2 (1分)
加热晶体前,通氮气可除去装置中的空气;加热晶体后,通氮气可把分解产生的气体产物全部赶出来。(其他合理答案也可,2分)
Ⅱ、①假设3:红色固体为Cu2O和Cu的混合物。(1分)
③实验过程(每空1分,先检验Cu2O、后检验Cu亦可)实验步骤 预期现象与结论 步骤1:取适量固体产物于试管中,加入足量浓氨水,充分振荡使其溶解 若固体产物全部溶解,则假设2成立;若固体产物未全部溶解,则假设1或假设3成立,接着进行下一步实验。 步骤2:另取适量固体产物于试管中,向其中加入适量稀硫酸溶液,充分振荡 若溶液变蓝色,结合步骤1,则假设3成立;
若溶液未变蓝色,结合步骤1,则假设1成立。
解析试题分析:Ⅰ、(1)无水硫酸铜遇水变蓝,可用量检验H2O的存在;CO2通入石灰水变浑浊,可用石灰水检验CO2。
(2)根据资料卡片:CO能与PdCl2溶液反应生成黑色的钯粉,可知PdCl2把CO氧化为CO2,配平可得方程式:PdCl2 + CO + H2O = Pd↓ + CO2 + 2HCl
(3)不能互换D、E两装置位置,如果颠倒顺序后,E装置产生CO2,会对D对CO2的检验产生干扰。
(4)2次用到A装置,第一次:加热晶体前,通氮气可除去装置中的空气;第二次:加热晶体后,通氮气可把分解产生的气体产物全部赶出来。
Ⅱ、①假设3为假设1和假设2的综合:红色固体为Cu2O和Cu的混合物。
③根据题目所给资料卡片:Cu2O能溶于浓氨水形成络合物,设计步骤1:取适量固体产物于试管中,加入足量浓氨水,充分振荡使其溶解。若固体产物全部溶解,说明只含Cu2O,则假设2成立;若固体产物未全部溶解,则假设1或假设3成立,接着进行下一步实验。根据Cu2O与H2SO4发生歧化反应,生成CuSO4和Cu,设计步骤2:另取适量固体产物于试管中,向其中加入适量稀硫酸溶液,充分振荡;则若溶液变蓝色,结合步骤1,则假设3成立;若溶液未变蓝色,结合步骤1,则假设1成立。
考点:本题考查物质的作用、方程式的书写、实验方案的试剂与分析评价。

苯甲酸常用于抗真菌及消毒防腐。实验室常用高锰酸钾氧化甲苯制备苯甲酸,其装置如图甲所示(加热、搅拌和仪器固定装置均已略去)。实验过程如下:
①将5.4 mL甲苯、100 mL水、几粒沸石加入250 mL三颈烧瓶中;
②装上冷凝管,加热至沸后分批加入16 g高锰酸钾,回流反应4 h;
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中;
④滤液加入盐酸酸化后,抽滤(装置如图乙)、洗涤、干燥得苯甲酸粗产品。
在苯甲酸制备过程中发生反应: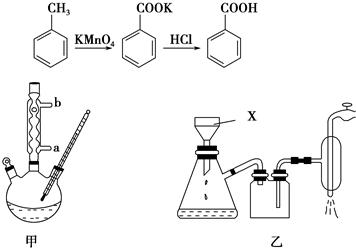
(1)图甲冷凝管中冷水应从________(填“a”或“b”)管进入,图乙中仪器X的名称为________。
(2)实验中分批加入KMnO4的原因是_________________________。
(3)判断甲苯被氧化完全的实验现象是___________________________。
(4)抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是__________________________________________________________。
(5)第一次过滤时,若溶液呈红色,可加入下列试剂处理________(填字母)。
| A.H2O | B.CCl4 |
| C.NaHSO3 | D.HNO3 |
| T/℃ | 4 | 18 | 75 |
| 溶解度/g | 0.18 | 0.27 | 2.20 |
洗涤苯甲酸晶体时应用________洗涤。
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,该晶体具有Na2CO3和H2O2的双重性质。利用图-2装置制备过碳酸钠,在冷水浴中充分反应后,按图-1流程可获得过碳酸钠产品。

(1)恒压滴液漏斗中支管的作用是 。
(2)制备过碳酸钠的关键是 。
(3)如果配制过碳酸钠的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(写出其中一种即可,用方程式表示)。________________________________;
(4)某化学学习小组为了定性探究铁离子对这种新型漂白剂的不良影响,取该漂白剂100mL,加入25g FeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.1mol/LNaOH溶液、8.0mol/LNaOH溶液、澄清石灰水、0.01mol/LKMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2; 假设2:气体是______________; 假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论:
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有_______、________的洗气瓶中,________________________。 | ①________________________ ②________________________ ③________________________ |
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:①在酸性条件下,I- 能被NO3- 氧化成IO3-,被H2O2或O2等氧化为I2;② IO3- 能被HSO3- 还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、IO3- 中的哪一种。
限选试剂如下:1.0 mol?L-1HNO3溶液、1.0 mol?L-1H2SO4溶液、1.0 mol?L-1NaHSO3溶液、3%H2O2溶液、1%淀粉溶液、蒸馏水。
(1)提出假设
假设1:该食盐样品中含I2;
假设2:该食盐样品中含I-;
假设3: 。
(2)设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表:
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液,振荡 | 若溶液显 (填颜色),则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: | 若溶液显蓝色,则假设2成立,反应的离子方程式为 ;否则,假设2不成立,再进行步骤3 |
| 步骤3: | |
(3)问题与思考
纯KIO3或纯KI都可以作为食用加碘盐中碘的来源。从化学角度来看,实验中添加 (填“KIO3”或“KI”)更好,理由是 。
用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物。(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出。请回答下列问题: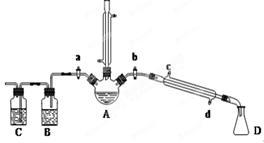
(1)仪器D的名称是 。
(2)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷。写出该反应的化学方程式 。
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢等。熄灭A处酒精灯,在竖直冷凝管上方塞上塞子,打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物。B、C中应盛放的试剂分别是 、 。
(4)在实验过程中,发现A中液体由无色逐渐变成黑色,该黑色物质与浓硫酸反应的化学方程式为 ,可在竖直冷凝管的上端连接一个内装吸收剂碱石灰的干燥管,以免污染空气。
(5)相关有机物的数据如下:
| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
(6)若实验中所取1-丁醇、NaBr分别为7.4 g、13.0 g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6 g 1-溴丁烷,则1-溴丁烷的产率是 。
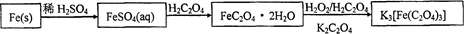
 溶液
溶液
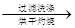 得固体b g
得固体b g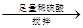
 量气测得气体体积Va mL
量气测得气体体积Va mL 250 mL溶液
250 mL溶液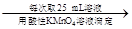 三次平均消耗0.1 mol·L-1酸性KMnO4溶液Vb mL你认为以上方案中 无法确定样品的组成,理由是 。
三次平均消耗0.1 mol·L-1酸性KMnO4溶液Vb mL你认为以上方案中 无法确定样品的组成,理由是 。

