题目内容
在其他条件不变时,改变某一条件对A2(g)+3B2(g)  2AB3(g)化学平衡状态的影响,得到如右图所示的变化规律(T表示温度)。下列结论正确的是
2AB3(g)化学平衡状态的影响,得到如右图所示的变化规律(T表示温度)。下列结论正确的是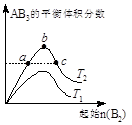
A.a、c两点A2的转化率相等
B.向a点的平衡体系中加入A2,可达到b点的平衡状态
C.b点时,平衡体系中A、B原子数之比最接近于1:3
D.正反应一定是吸热反应,且T2>T1
C
解析试题分析:A、反应中随B2(g)量的增大,A2(g)转化率增大,c点转化率高于a点,错误;B、a点A2(g)的浓度大,再加入B2(g)量才能达到b点,错误;C、正确;D、不知道反应的热效应,不能判断吸放热和温度的高低,错误。
考点:考查化学平衡移动有关问题。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
25℃和1.01×105Pa时,反应:2N2O5(g) = 4NO2(g)+O2(g) △H= +56.76kJ/mol,自发进行的原因是
| A.是吸热反应 | B.是放热反应 |
| C.是熵减少的反应 | D.熵增大效应大于能量效应。 |
如图②为恒压容器,①③④为恒容容器,起始加入物如下,且起始容积均相等,维持恒温的条件下发生反应:2SO2(g)+O2(g)  2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是
2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是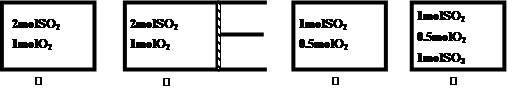
| A.197>Q1>Q2 | B.Q1>2Q3 | C.Q1=Q4 | D.Q3<Q4 |
在25℃和1.01×105Pa时,2N2O5(g)=4NO2(g) + O2(g);△H=+56.7kJ/mol,能自发进行的合理解释是( )
| A.是吸热反应 | B.是放热反应 | C.是熵减反应 | D.是熵增效应大于能量效应 |
2012年是勒夏特列诞生192周年,下列叙述中,不用平衡移动原理解释的是 ( )
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.高压比常压有利于合成SO3的反应 |
| C.由H2(g)、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
| D.黄绿色的氯水光照后颜色变浅 |
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A.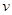 (W)=3 (W)=3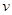 (Z) (Z) | B.2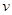 (X)=3 (X)=3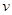 (Z) (Z) |
C.2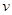 (X)= (X)=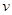 (Y) (Y) | D.3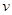 (W)=2 (W)=2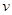 (X) (X) |
 2C(g) △H <0,下列各图正确的是( )
2C(g) △H <0,下列各图正确的是( )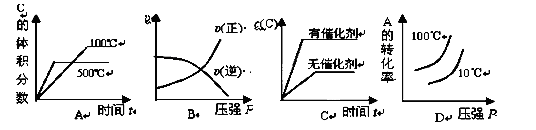
 xC(g)
xC(g) 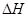 <0。测得两容器中c(A)随时间t的变化如图所示:
<0。测得两容器中c(A)随时间t的变化如图所示: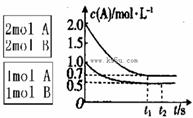
 PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率v(PCl5)="0.4" mol/(L·min),则这段时间为
PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率v(PCl5)="0.4" mol/(L·min),则这段时间为