题目内容
25℃和1.01×105Pa时,反应:2N2O5(g) = 4NO2(g)+O2(g) △H= +56.76kJ/mol,自发进行的原因是
| A.是吸热反应 | B.是放热反应 |
| C.是熵减少的反应 | D.熵增大效应大于能量效应。 |
D
解析试题分析:当熵增大效应大于能量效应反应可以自发进行,D正确。
考点:考查能量。

练习册系列答案
 互动课堂系列答案
互动课堂系列答案
相关题目
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s) ΔH>0
Z(g)+W(s) ΔH>0
下列叙述正确的是
| A.加入少量W,逆反应速率增大 | B.当容器中气体的密度不变时,反应达到平衡 |
| C.升高温度,Y的百分含量增加 | D.平衡后加入X,上述反应的ΔH增大 |
高温下,某反应达到平衡,平衡常数 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的化学方程式为CO+H2O CO2+H2 CO2+H2 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.该反应的焓变为正值 |
对已经达到化学平衡的2X(g)+Y(g) 2Z(g)减小压强时,对反应的影响是( )
2Z(g)减小压强时,对反应的影响是( )
| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向逆反应方向移动 |
| D.正、逆反应速率都增大,平衡向正反应方向移动 |
可逆反应mA(固)+nB(气)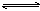 eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )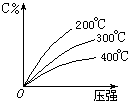
| A.达平衡后,加入催化剂则C%增大 |
| B.化学方程式中n>e+f |
| C.达平衡后,若升温,平衡右移 |
| D.达平衡后,增加A的量有利于平衡向右移动 |
已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是
| A.v(CO)=1.5 mol·L-1·min-1 |
| B.v(NO2)=0.7 mol·L-1·min-1 |
| C.v(N2)=0.4 mol·L-1·min-1 |
| D.v(CO2)=1.1 mol·L-1·min-1 |
升高温度,下列数据不一定增大的是
| A.化学反应速率 | B.水的离子积常数Kw |
| C.化学平衡常数 | D.弱酸的电离平衡常数Ka |
 NH3·H2O
NH3·H2O NH4++OH-;②气体的溶解度随温度的升高而降低。实验室中也常用氨水滴入生石灰中制取氨气,请用平衡的有关理论来解释之。
NH4++OH-;②气体的溶解度随温度的升高而降低。实验室中也常用氨水滴入生石灰中制取氨气,请用平衡的有关理论来解释之。 2AB3(g)化学平衡状态的影响,得到如右图所示的变化规律(T表示温度)。下列结论正确的是
2AB3(g)化学平衡状态的影响,得到如右图所示的变化规律(T表示温度)。下列结论正确的是