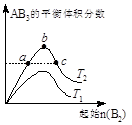题目内容
如图②为恒压容器,①③④为恒容容器,起始加入物如下,且起始容积均相等,维持恒温的条件下发生反应:2SO2(g)+O2(g)  2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是
2SO3(g) △H = –197kJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是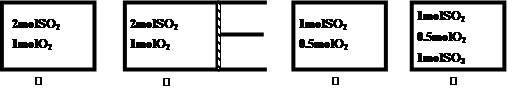
| A.197>Q1>Q2 | B.Q1>2Q3 | C.Q1=Q4 | D.Q3<Q4 |
B
解析试题分析:A、容器②相当于①容器达到平衡状态后再加压,而加压时平衡向右移动,反应物转化率增大,放出的热量更多,即Q2>Q1,故A错误;B、当③容器容积①容器容积一半大小时,两容器可建立等效平衡,此时①放热等于③放热的2倍,再将③容积扩大2倍以满足题中条件时,平衡逆向移动,反应物转化率降低,放热减少,即Q1>2Q3,故B正确;C、①和④两容器的平衡状态是等效平衡,但起始状态不同,所以放热不相等,故C错误;D、④相当于在③达到平衡后,再加入1molSO3,而增大SO3的浓度平衡逆向移动,放热必然减少,即Q3>Q4,故D错误。
考点:考查等效平衡、平衡移动与反应的热效应。

已知反应4CO+2NO2 N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是
| A.v(CO)=1.5 mol·L-1·min-1 |
| B.v(NO2)=0.7 mol·L-1·min-1 |
| C.v(N2)=0.4 mol·L-1·min-1 |
| D.v(CO2)=1.1 mol·L-1·min-1 |
升高温度,下列数据不一定增大的是
| A.化学反应速率 | B.水的离子积常数Kw |
| C.化学平衡常数 | D.弱酸的电离平衡常数Ka |
下列事实不能用平衡移动原理解释的是
| A.工业合成氨时使用催化剂 |
| B.配制FeCl3溶液时加入少量的盐酸 |
| C.在Na2CO3溶液中,由水电离出的c(OH-) >1×10-7mol/L |
| D.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
| A.加入适量的6 mol·L-1的盐酸 | B.加入数滴氯化铜溶液 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |
某温度下,把3molA和2.5molB混合,盛入容积为2L的容器内,使它们发生反应:
3A(气)+B(气) xC(气)+2D(气)
xC(气)+2D(气)
经过5min后达到平衡生成1mol D , 测得C的平均生成速率为0.10mol·L-1·min-1。下列叙述不正确的是( )
| A.x的值为2 |
| B.B的转化率为20% |
| C.平衡常数为1/3 |
| D.A的平均消耗速率为0.15mol·L-1·min-1 |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g) ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是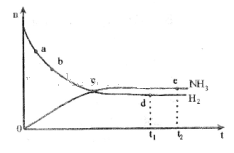
| A.点a的正反应速率比点b的小 |
| B.点c处反应达到平衡 |
C.点d( 时刻)和点e( 时刻)和点e( 时刻)处n( 时刻)处n( )不一样 )不一样 |
D.其他条件不变,773K下反应至 时刻,n(H2)比上图 时刻,n(H2)比上图 |
 NH3·H2O
NH3·H2O NH4++OH-;②气体的溶解度随温度的升高而降低。实验室中也常用氨水滴入生石灰中制取氨气,请用平衡的有关理论来解释之。
NH4++OH-;②气体的溶解度随温度的升高而降低。实验室中也常用氨水滴入生石灰中制取氨气,请用平衡的有关理论来解释之。 2AB3(g)化学平衡状态的影响,得到如右图所示的变化规律(T表示温度)。下列结论正确的是
2AB3(g)化学平衡状态的影响,得到如右图所示的变化规律(T表示温度)。下列结论正确的是