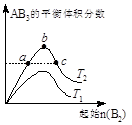题目内容
将0.5mol PCl5充入体积为1L的密闭容器中,发生反应PCl5 PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率v(PCl5)="0.4" mol/(L·min),则这段时间为
PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率v(PCl5)="0.4" mol/(L·min),则这段时间为
| A.80s | B.45s | C.30s | D.15s |
C
解析试题分析:由题意知,参加反应的PCl5量为0.2mol,由速率的公式可知,时间为0.2/0.4=0.5min,即30s。
考点:化学反应速率的计算。

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g) ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是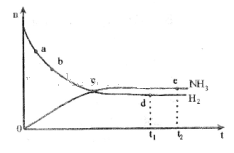
| A.点a的正反应速率比点b的小 |
| B.点c处反应达到平衡 |
C.点d( 时刻)和点e( 时刻)和点e( 时刻)处n( 时刻)处n(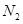 )不一样 )不一样 |
D.其他条件不变,773K下反应至 时刻,n(H2)比上图 时刻,n(H2)比上图 |
下列事实,不能用勒夏特列原理解释的是
| A.新制的氯水在光照下颜色变浅 |
| B.H2、I2、HI平衡混合气加压后颜色变深 |
| C.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
| D.实验室用排饱和食盐水而不用排水法收集氯气 |
把下列4种X的溶液分别加入4个盛有10mL2mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时X和盐酸缓和地进行反应。其中反应速率最大的是
| A.20mL3mol·L-1的X溶液 | B.20mL2mol·L-1的X溶液 |
| C.10mL4mol·L-1的X溶液 | D.10mL2mol·L-1的X溶液 |
下列说法中有明显错误的是
| A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 |
| B.活化分子之间发生的碰撞不一定为有效碰撞 |
| C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大 |
| D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率 |
在2升的密闭容器中,反应物的物质的量为3mol,经过20s后,它的物质的量变成了1mol,在这20s内它的反应速率为 ( )
| A.0.1 mol / (L·S) | B.0.05mol /( L·min) |
| C.0.05mol / (L·S) | D.0.8mol / (L·S) |
反应C(s)+H2O(g) CO(g)+H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
| A.在密闭容器中通入水蒸气 |
| B.升温 |
| C.保持体积不变,充入氦气使体系压强增大 |
| D.保持压强不变,充入氦气使容器体积增大 |
某反应2AB(g) C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的△H、△S应为
C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的△H、△S应为
| A.△H<0,△S>0 | B.△H<0,△S<0 | C.△H>0,△S>0 | D.△H>0,△S<0 |
 2AB3(g)化学平衡状态的影响,得到如右图所示的变化规律(T表示温度)。下列结论正确的是
2AB3(g)化学平衡状态的影响,得到如右图所示的变化规律(T表示温度)。下列结论正确的是