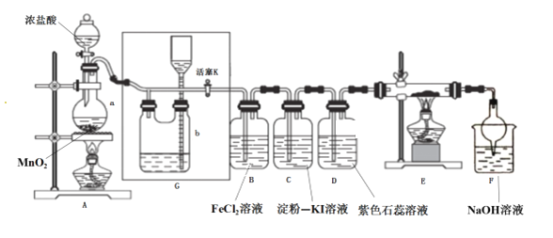
题目内容
【题目】以锌锰废电池中的碳包(含碳粉、Fe、Cu、Ag和MnO2等物质 )为原料回收MnO2的工艺流程如下:
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II.将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
III.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV. 向III所得溶液(pH约为6)中缓慢滴加0.50 molL-1 Na2CO3溶液,过滤,得滤渣b,其主要成分为MnCO3;
V. 滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι中Ag与足量稀HNO3反应生成NO的化学方程式为____________________。
(2)已知II的灼烧过程中同时发生反应:
MnO2(s)+C(s) = MnO(s) + CO (g) △H=+24.4 kJ mol -1
MnO2(s)+CO(g) = MnO(s)+CO2(g) △H=-148.1 kJ mol -1
写出MnO2和C反应生成MnO和CO2的热化学方程式:________。
(3)H2O2分子中含有的化学键类型为________、________。
(4)III中MnO2溶解的离子方程式为________,溶解一定量的MnO2,H2O2的实际消耗量比理论值高,用化学方程式解释原因:______________________________________。
(5)IV中,若改为“向0.50 molL-1 Na2CO3溶液中缓慢滴加III所得溶液”,滤渣b中会混有较多Mn(OH)2沉淀,解释其原因:________________________________________。
(6)V中MnCO3在空气中灼烧的化学方程式为________。
【答案】3Ag+4HNO3=3AgNO3+NO+2H2O2MnO2(s)+C(s)= 2MnO(s)+CO2(g) △H =-123.7 kJmol-1极性键非极性键MnO2 +H2O2 +2H+ =Mn2+ +O2+2H2O2H2O2![]() O2+2H2ONa2CO3溶液pH>7显碱性,III所得溶液pH约为6 显弱酸性,后者滴加到前者中,溶液中c(OH-)较大,Mn2+与OH-生成Mn (OH)2沉淀(或答CO32-的水解平衡正向移动生成Mn (OH)2沉淀)2MnCO3 + O2
O2+2H2ONa2CO3溶液pH>7显碱性,III所得溶液pH约为6 显弱酸性,后者滴加到前者中,溶液中c(OH-)较大,Mn2+与OH-生成Mn (OH)2沉淀(或答CO32-的水解平衡正向移动生成Mn (OH)2沉淀)2MnCO3 + O2 ![]() 2MnO2 + 2CO2
2MnO2 + 2CO2
【解析】
(1)稀硝酸具有强氧化性,与银反应生成一氧化氮、硝酸银和水;
(2)依据盖斯定律进行解析;
(3同种非金属元素间易形成非极性共价键,不同种非金属元素之间易形成极性共价键;
(4)MnO2 与H2O2在酸性条件下发生氧化还原反应,同时,在二氧化锰作催化剂的条件下,双氧水发生分解;
(5)改为向0.50 molL-1 Na2CO3溶液中缓慢滴加含有锰离子的溶液,碳酸根离子水解平衡右移,生成Mn(OH)2沉淀;
(6)碳酸锰在空气中灼烧,能够被氧气氧化生成二氧化锰和二氧化碳;
(1)Ⅰ中Ag 与足量稀HNO3反应生成NO、AgNO3;化学方程式为:3Ag+4HNO3 =3AgNO3 +NO+2H2O;正确答案:3Ag+4HNO3 =3AgNO3 +NO+2H2O。
(2)①MnO2(s)+C(s) = MnO(s) + CO (g) △H=+24.4 kJ mol -1;②MnO2(s)+CO(g) = MnO(s)+CO2(g) △H=-148.1 kJ mol -1,根据盖斯定律①+②得到2MnO2(s)+C(s)= 2MnO(s)+CO2(g) △H =-123.7 kJmol-1 ;正确答案:2MnO2(s)+C(s)= 2MnO(s)+CO2(g) △H =-123.7 kJmol-1。
(3)H2O2为共价分子,含有氧氧非极性键和氢氧极性键;正确答案:极性键;非极性键。
(4)粗MnO2 中加入酸性H2O2溶液, MnO2溶解生成Mn2+ ,锰元素得电子,化合价降低,H2O2中氧元素失电子化合价升高,得到氧气,化学方程式为MnO2 +H2O2 +2H+ =Mn2+ +O2+2H2O;由于常温下存在过氧化氢分解,2H2O2![]() O2+2H2O,所以加入H2O2的实际消耗量比理论值高;正确答案:MnO2 +H2O2 +2H+ =Mn2+ +O2+2H2O; 2H2O2
O2+2H2O,所以加入H2O2的实际消耗量比理论值高;正确答案:MnO2 +H2O2 +2H+ =Mn2+ +O2+2H2O; 2H2O2![]() O2+2H2O。
O2+2H2O。
(5)碳酸根离子水解导致溶液呈碱性,向0.50 molL-1 Na2CO3溶液中缓慢滴加Ⅲ所得溶液(显弱酸性),由于c(OH-)较大,Mn2+与OH-生成Mn(OH)2沉淀;正确答案:Na2CO3溶液pH>7显碱性,III所得溶液pH约为6 显弱酸性,后者滴加到前者中,溶液中c(OH-)较大,Mn2+与OH-生成Mn (OH)2沉淀(或答CO32-的水解平衡正向移动生成Mn(OH)2沉淀)。
(6)MnCO3在空气中灼烧得到MnO2,锰元素失电子化合价升高,氧元素得电子化合价降低,化学方程式为2MnCO3 +O2 ![]() 2MnO2 + 2CO2;正确答案:2MnCO3 + O2
2MnO2 + 2CO2;正确答案:2MnCO3 + O2 ![]() 2MnO2 + 2CO2。
2MnO2 + 2CO2。

 字词句段篇系列答案
字词句段篇系列答案