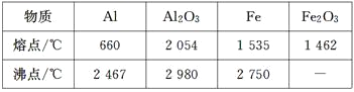
题目内容
【题目】关于下列物质的用途,说法正确的是
A.纯碱用于焙制糕点B.用铁容器存放浓盐酸
C.明矾可用作净水剂D.高纯度的硅单质用于制作光导纤维
【答案】C
【解析】
A.碳酸氢钠受热分解生成碳酸钠和CO2,可以用于焙制糕点,而纯碱是碳酸钠,故A错误;
B.铁能与浓盐酸反应,不能用来盛装浓盐酸,故B错误;
C.明矾溶于水电离产生铝离子,铝离子水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性,能吸附水中的杂质,所以能净水,故C正确;
D.光导纤维的成分是二氧化硅,高纯度的硅单质广泛用于制作硅能电池,故D错误;
故答案为C。

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目