题目内容
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,根据如图所示的实验装置,回答下列问题:
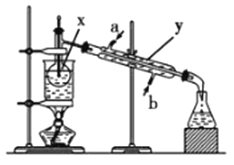
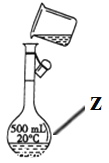
(1)写出下列仪器的名称:x_________;y_____________;z_____________。
(2)仪器y的进水口为_____________(填“a”或“b”)。
(3)请分别指出图中的一处错误_____________________,_________________。
(4)在配置1.0mol/L盐酸溶液时,下列操作会导致所配溶液浓度偏大的是___________(填写字母,下同);浓度不变的是_______。
A.用量筒量取浓盐酸时,俯视量筒刻度线
B.容量瓶未干燥即用来配置溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容后,将容量瓶倒置摇匀,发现液面低于刻度线,继续加水至刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
F.未进行洗涤操作
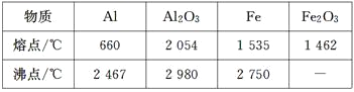
【答案】蒸馏烧瓶 冷凝管 500mL容量瓶 b 温度计水银球伸入液面下 未用玻璃棒引流 E B
【解析】
(1)由图及常见仪器可知名称;
(2)根据冷水在冷凝管中下进上出,冷凝效果好判断;
(3)根据装置判断其错误;
(4)结合c=n÷V及不当操作对n、V的影响分析。
(1)根据仪器的构造可知x、y、z分别是蒸馏烧瓶、冷凝管、500mL容量瓶。
(2)蒸馏时为充分冷却,冷凝管下口是进水口,上口是出水口,因此仪器y的进水口为b。
(3)蒸馏时温度计测量的是蒸汽的温度,不是溶液的温度,则装置中的错误是温度计水银球伸入液面下;配制一定物质的量浓度的溶液时必须用玻璃棒引流,防止液体外溅,因此装置中的错误是未用玻璃棒引流;
(4)A.用量筒量取浓盐酸时,俯视量筒刻度线,实际量取的盐酸减少,所以所配溶液的浓度偏小;
B.容量瓶未干燥即用来配置溶液,n、V均无影响,则浓度不变;
C.浓盐酸在烧杯中稀释时,搅拌时间过长,盐酸挥发,溶质的物质的量减少,所以所配溶液的浓度偏小;
D.定容后,将容量瓶倒置摇匀,发现液面低于刻度线,继续加水至刻度线,溶液的体积增加,所以所配溶液的浓度偏小;
E.在容量瓶中定容时俯视容量瓶刻度线,V偏小,所以所配溶液的浓度偏大;
F.未进行洗涤操作,溶质的物质的量减少,所以所配溶液的浓度偏小;
因此所配溶液浓度偏大的是E;浓度不变的是B。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案