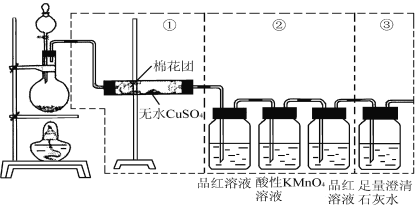
题目内容
【题目】2004年4月15日,重庆某化工厂氯气泄露并发生爆炸,爆炸现场弥漫着黄色烟雾,这起事故共造成7人丧生,并致使近15万群众紧急疏散。问题:
(1)爆炸现场弥漫的黄色烟雾,除氯气外,形成雾的主要原因是Cl2与水反应,反应的化学方程式为___________________________________;形成烟的成分包含Cl2与Fe反应的产物___________,Cl2是一种有毒气体,为消除毒气,消防部门用消防用水与碱液在外围50米处形成两道水幕进行稀释,写出Cl2与强碱溶液反应的离子方程式__________________________________。
(2)Cl2及其无机产品常用做消毒剂,如“84消毒液”(NaClO)、“漂白粉”等,它们的消毒原理都是在潮湿的空气中与CO2和水蒸气反应生成了次氯酸,请写出“84消毒液”(NaClO)在空气中发生作用的化学方程式:________________________________。
(3)用氯气对饮用水消毒已经有百年的历史,这种消毒的方法中氯气会与水中的有机物发生氯代生成对人体有害的的氯代物,于是世界环保联盟建议推广广谱高效消毒剂二氧化氯(ClO2),制取二氧化氯的其中一种方法是:Na2SO3+2NaClO3+H2SO4=2Na2SO4+2ClO2↑+H2O,该反应中氧化剂是_______,还原剂是_______,氧化剂与还原剂的物质的量之比为_________;若生成1mol ClO2则转移电子数为____________(NA表示阿伏伽德罗常数)。
【答案】H2O+Cl2=HClO+HCl FeCl3 Cl2+2OH—=ClO—+Cl—+H2O 2NaClO+H2O+CO2=Na2CO3+2HClO NaClO3 Na2SO3 2:1 NA
【解析】
(1)Cl2与水反应生成盐酸和次氯酸,反应的化学方程式为H2O+Cl2![]() HClO+HCl;Cl2具有强氧化性,所以Cl2与Fe反应生成FeCl3;Cl2与强碱溶液反应生成盐酸盐、次氯酸盐和水,离子方程式为:Cl2+2OH—=ClO—+Cl—+H2O,故答案为:H2O+Cl2
HClO+HCl;Cl2具有强氧化性,所以Cl2与Fe反应生成FeCl3;Cl2与强碱溶液反应生成盐酸盐、次氯酸盐和水,离子方程式为:Cl2+2OH—=ClO—+Cl—+H2O,故答案为:H2O+Cl2![]() HClO+HCl;FeCl3;Cl2+2OH—=ClO—+Cl—+H2O。
HClO+HCl;FeCl3;Cl2+2OH—=ClO—+Cl—+H2O。
(2)NaClO在空气中发生作用是因为NaClO与空气中的二氧化碳反应生成HClO,HClO具有强氧化性,可以用于杀菌、消毒,反应的化学方程式为:2NaClO+H2O+CO2=Na2CO3+2HClO,故答案为:2NaClO+H2O+CO2=Na2CO3+2HClO。
(3)该反应Na2SO3+2NaClO3+H2SO4=2Na2SO4+2ClO2↑+H2O中,Na2SO3中S元素的化合价由+4价升高为+6价,则Na2SO3是还原剂,发生氧化反应,NaClO3中Cl元素的化合价由+5价降低为+4价,则NaClO3是氧化剂,发生还原反应,物质的量之比等于化学计量数之比,故氧化剂与还原剂的物质的量之比为2:1,由反应方程式可知,生成1个ClO2转移1个电子,故生成1mol ClO2则转移电子数为NA,故答案为:NaClO3;Na2SO3;2:1;NA。

【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第3周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图_____________ ;X元素的气态氢化物与其最高价含氧酸反应的离子方程式为______________;
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是__________(填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强