题目内容
【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第3周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图_____________ ;X元素的气态氢化物与其最高价含氧酸反应的离子方程式为______________;
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是__________(填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
【答案】![]() NH3 + H+ = NH4+ Na cd
NH3 + H+ = NH4+ Na cd
【解析】
T元素最外层电子数是次外层电子数的3倍,最外层电子数不超过8个,因此次外层电子数=2,最外层电子数=6,该元素是O元素;X常温下单质为双原子分子,分子中含有3对共用电子对,该单质为N2,则X为N元素;Y元素M层比K层少1个电子,则Y元素原子序数是2+8+1=11,为Na元素;Z元素在第3周期金属元素的简单离子中半径最小,则Z是Al元素,据此分析解答。
根据上述分析,T为O元素,X为N元素,Y为Na元素,Z是Al元素。
(1)O原子核外有2个电子层、最外层电子数是6,其原子结构示意图为![]() ;X为N元素,氮元素的气态氢化物与其最高价含氧酸反应的离子方程式为:NH3+H+=NH4+,故答案为:
;X为N元素,氮元素的气态氢化物与其最高价含氧酸反应的离子方程式为:NH3+H+=NH4+,故答案为:![]() ;NH3+H+=NH4+;
;NH3+H+=NH4+;
(2)同一周期的元素,元素的金属性随着原子序数增大而减弱,所以Na的金属性大于Al;金属的金属性强弱判断方法有:金属与水或水置换出氢气的难易程度、金属之间的置换反应、其最高价氧化物的水化物碱性强弱,所以能证明钠的金属性大于Al的有Y单质与水反应比Z单质剧烈、Y最高价氧化物的水化物的碱性比Z强,故选cd,故答案为:Na;cd。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】活性氧化锌是一种多功能性的新型无机材料.某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
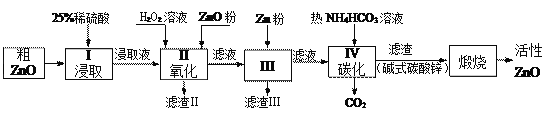
已知各相关氢氧化物沉淀pH范围如下表所示:
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
完成下列填空:
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要_____(选填编号)
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤II中加入H2O2溶液的作用是_________________________(用离子方程式表示);
(3)用ZnO调节pH,以除去含铁杂质,调节pH的适宜范围是_______________________。
(4)步骤III中加入Zn粉的作用是:①__________________;②进一步调节溶液pH。
(5)碱式碳酸锌[Zn2(OH)2 CO3]煅烧的化学方程式为________________________________。
(6)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
① 取1.000g活性氧化锌,用15.00mL 1.000mol·L-1 硫酸溶液完全溶解,滴入几滴甲基橙。② 用浓度为0.5000mol·L-1 的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL。判断滴定终点的方法是________;所得活性氧化锌的纯度为________(相对原子质量 O-16 Zn-65 )。