题目内容
【题目】雾霾天气严重影响人们的生活,汽车尾气所排放的氮氧化物及燃煤所排放的硫氧化物是造成雾霾的重要原因。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:

① 由图1可知,SCR技术中的氧化剂为__________________。
已知c(NO2)∶c(NO)=1∶1时脱氮效果最佳,若生成1molN2时反应放出的热量为QkJ。此时对应的脱氮反应的热化学方程式为___________________。
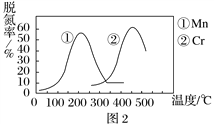
② 图2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相应的温度分别为________________。
(2)改善能源结构是治理雾霾问题的最直接有效途径。二甲醚是一种清洁能源,可用合成气在催化剂存在下制备二甲醚,其反应原理为:2CO(g)+4H2(g)![]() CH3OCH3 (g)+H2O(g) ΔH
CH3OCH3 (g)+H2O(g) ΔH
已知在一定条件下,该反应中CO的平衡转化率α随温度、投料比![]() 的变化曲线如图3所示。
的变化曲线如图3所示。

① a、b、c按由大到小的顺序排序为____;ΔH__0(填“>”“<”或“=”)。
② 对于气相反应,用某组分(B)的平衡分压p(B)代替物质的量浓度c(B)也可以表示平衡常数(记作Kp),则该反应平衡常数的表达式Kp=_______。
③ 在恒容密闭容器里按体积比为1∶2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是_____。
A. 一氧化碳的转化率减小
B. 容器的压强增大
C. 化学平衡常数K值减小
D. 逆反应速率先增大后减小
E. 混合气体的密度增大
【答案】 NO、NO2 2NH3(g)+NO(g)+NO2(g)===2N2(g)+3H2O(g) ΔH=-2QkJ·mol-1 Mn、200℃左右 a>b>c < ![]() CD
CD
【解析】(1)①得电子化合价降低的反应物是氧化剂;生成1mol氮气放出QkJ热量,则生成2mol氮气放出2QkJ热量;②温度越高,对设备的要求越高,所以如果催化剂在较低温度下能较大程度的脱氢即可;
(2)①反应2CO(g)+4H2(g)![]() CH3OCH3 (g)+H2O(g) ΔH,增大H2的浓度,平衡右移,CO的转化率增大,即投料比
CH3OCH3 (g)+H2O(g) ΔH,增大H2的浓度,平衡右移,CO的转化率增大,即投料比![]() 增大,CO的转化率增大;正反应为气体物质的量减小的反应,为熵减反应,△S<0,而△H-T△S<0反应自发进行,该反应在低温下能自发进行,该反应的△H<0;
增大,CO的转化率增大;正反应为气体物质的量减小的反应,为熵减反应,△S<0,而△H-T△S<0反应自发进行,该反应在低温下能自发进行,该反应的△H<0;
②由题目信息可知,某组分(B)的平衡分压p(B)代替物质的量浓度c(B)表示平衡常数为:生成物分压的系数次幂乘积与反应物分压的系数次幂乘积的比;
③A. 增大一氧化碳的物质的量,平衡正向移动,但一氧化碳的转化率减小;B. 容器的压强增大,平衡正向移动;C. 化学平衡常数K值减小,说明平衡逆向移动;D. 逆反应速率先增大后减小,说明平衡逆向移动;E. 移走生成物的量,平衡正向移动,混合气体总质量减小,容器容积不变,混合气体密度减小;以此解答。
(1)①根据图象知,反应物是NO、NO2和NH3,生成物是N2和H2O,氮氧化物中N元素化合价由正化合价变为0价、氨气中N元素化合价由-3价变为0价,所以氧化剂是NO、NO2;生成1mol氮气放出QkJ热量,则生成2mol氮气放出2QkJ热量,则其热化学反应方程式为2NH3(g)+NO(g)+NO2(g)2N2(g)+3H2O(g)△H=-2QkJ/mol。
故答案为:NO、NO2;2NH3(g)+NO(g)+NO2(g)2N2(g)+3H2O(g)△H=-2QkJ/mol;
②根据图象知,脱氢率越高越好,但Cr作催化剂时温度高于Mn,温度越高,对设备要求越高,增大生产成本,且脱氢率增大较小,所以使用Mn作催化剂较好;根据图象知,在温度为200左右,脱氢率较高,故答案为:Mn;200℃左右;
(2)①反应2CO(g)+4H2(g)![]() CH3OCH3 (g)+H2O(g) ΔH,增大H2的浓度,平衡右移,CO的转化率增大,即投料比
CH3OCH3 (g)+H2O(g) ΔH,增大H2的浓度,平衡右移,CO的转化率增大,即投料比![]() 增大,CO的转化率增大,故a>b>c。
增大,CO的转化率增大,故a>b>c。
正反应为气体物质的量减小的反应,为熵减反应,△S<0,而△H-T△S<0反应自发进行,该反应在低温下能自发进行,该反应的△H<0;
②由题目信息可知,某组分(B)的平衡分压p(B)代替物质的量浓度c(B)表示平衡常数为:生成物分压的系数次幂乘积与反应物分压的系数次幂乘积的比,2CO(g)+4H2(g)![]() CH3OCH3 (g)+H2O(g),Kp=
CH3OCH3 (g)+H2O(g),Kp=![]() 。
。
③A. 增大一氧化碳的物质的量,平衡正向移动,但一氧化碳的转化率减小,故A错误;
B. 容器的压强增大,平衡正向移动,故B错误;
C. 化学平衡常数K值减小,说明平衡逆向移动,故C正确;
D. 逆反应速率先增大后减小,说明平衡逆向移动,故D正确;
E. 移走生成物的量,平衡正向移动,混合气体总质量减小,容器容积不变,混合气体密度减小,故E错误;
因此,本题答案选CD。

【题目】活性氧化锌是一种多功能性的新型无机材料.某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
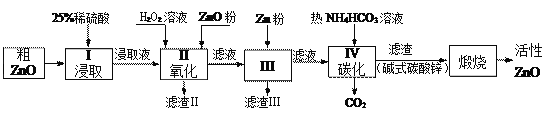
已知各相关氢氧化物沉淀pH范围如下表所示:
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
完成下列填空:
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要_____(选填编号)
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤II中加入H2O2溶液的作用是_________________________(用离子方程式表示);
(3)用ZnO调节pH,以除去含铁杂质,调节pH的适宜范围是_______________________。
(4)步骤III中加入Zn粉的作用是:①__________________;②进一步调节溶液pH。
(5)碱式碳酸锌[Zn2(OH)2 CO3]煅烧的化学方程式为________________________________。
(6)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
① 取1.000g活性氧化锌,用15.00mL 1.000mol·L-1 硫酸溶液完全溶解,滴入几滴甲基橙。② 用浓度为0.5000mol·L-1 的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL。判断滴定终点的方法是________;所得活性氧化锌的纯度为________(相对原子质量 O-16 Zn-65 )。

