题目内容
【题目】下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
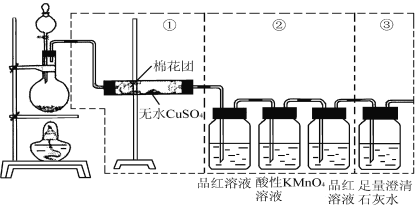
(1)浓硫酸与木炭粉在加热条件下的化学方程式为______________________________。
(2)酸性高锰酸钾溶液的作用是____________;第二个品红溶液的作用是__________________________;说明存在CO2的实验现象是______________________________________________ 。
(3)如果装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检验出的物质是___________;不能检出的物质是____________。
(4)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是_____________;不能检出的物质是_____________。
【答案】2H2SO4+C=CO2↑+2SO2↑+2H2O 吸收多余的SO2 检验SO2是否除净 第二个品红溶液不褪色,澄清石灰水中出现白色浑浊 SO2、CO2 H2O H2O CO2、SO2
【解析】
(1)碳可以和浓硫酸反应生成二氧化碳、二氧化硫以及水;
(2)用品红检验二氧化硫的生成,用酸性高锰酸钾溶液吸收多余的SO2,用澄清石灰水检验二氧化碳的生成,但是二氧化碳检验之前需要先把二氧化硫除净;
(3)二氧化碳和二氧化硫均可以使澄清的石灰水变浑浊;
(4)将混合气体通过某种水溶液之后,再检验水的存在与否是错误的,因为这些水溶液中含有水。
(1)碳可以和浓硫酸反应生成二氧化碳、二氧化硫以及水,即C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O。
(2)酸性高锰酸钾溶液的作用是吸收多余的SO2;第二个品红溶液的作用是检验SO2是否除净;若存在CO2,则第二个品红溶液不褪色,澄清石灰水中出现白色浑浊;故答案为:吸收多余的SO2;检验SO2是否除净;第二个品红溶液不褪色,澄清石灰水中出现白色浑浊。
(3)如果将装置中①、②、③三部分仪器的连接顺序改为②可以检验并除去二氧化硫,①可以检验水的存在,但是不一定是混合气体中的水,③可以检验二氧化碳的存在,故答案为:CO2、SO2;H2O。
(4)如果将仪器的连接顺序变为①、③、②,①可以确定水的存在,但是③既可以是二氧化碳的性质又可以是二氧化硫的性质,故答案为:H2O;CO2、SO2。

【题目】传统硅酸盐材料因其耐高温、抗腐蚀、强度高等优异性能,被广泛应用于各种工业、科学研究及日常生活中。某硅酸盐材料的主要成分为氧化钙、二氧化硅,并含有一定量铁、铝及镁的氧化物,某研究小组设计以下流程测定该硅酸盐材料中钙的含量(如下图所示)。

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度以0.1mol·L-1计)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Ca(OH)2 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 7.6 | 12.3 | 4.0 | 8.0 |
完全沉淀pH | 3.7 | 9.6 | 14.3 | 5.2 | 12.4 |
回答下列问题:
(1)酸浸后,加入双氧水所发生反应的离子方程式为_________________。为提高钙的浸出率,可以采取的措施是________________________。(任写一种)
(2)沉淀B的成份为_____________。调节滤液Ⅰ的pH为4~5,加入的物质可以是_________。
A. CaCO3 B. Ca(OH)2 C. 氨水 D. MgO
(3)向滤液Ⅱ中加足量草酸铵溶液,在水浴上保温陈化2小时,冷却到室温,过滤、洗涤沉淀。将得到的CaC2O4沉淀溶解在硫酸中,并稀释配成250mL溶液。用移液管量取25.00 mL溶液于锥形瓶中,用KMnO4标准溶液滴定。滴定时发生反应的离子方程式为___________________________。若实验中所取样品质量为4.00 g ,KMnO4标准溶液浓度为0.0500 mol/L,平行滴定3次用去KMnO4标准溶液体积平均值为36.00 mL,则该硅酸盐样品中钙的质量分数为_________。
(4)在保温沉钙环节,若样品中镁的含量过高,会导致最终测定结果产生较大误差。试从理论上计算,加草酸铵溶液沉钙时,溶液中镁离子的浓度最高不能超过____mol/L。(已知:Ksp(CaC2O4) = 4.00×10-9,Ksp(MgC2O4) = 4.83×10-6)