题目内容
3.键能是指断裂1mol化学键形成气态原子时吸收的能量(kJ),单位为kJ•mol-1.从手册上查得:H-H、Cl-Cl和H-Cl的键能分别为436kJ•mol-1、243kJ•mol-1和431kJ•mol-1,请用此数据估计,由Cl2、H2生成1mol H-Cl时应该( )| A. | 放热183 kJ | B. | 放热91.5 kJ | C. | 吸热183 kJ | D. | 吸热91.5 kJ |
分析 H-H、Cl-Cl和H-Cl的键能分别为436kJ•mol-1、243kJ•mol-1和431kJ•mol-1,结合Cl2(g)+H2(g)=2HCl(g)及△H=反应物总键能-生成物总键能计算.
解答 解:H-H、Cl-Cl和H-Cl的键能分别为436kJ•mol-1、243kJ•mol-1和431kJ•mol-1,
即需要断裂1molCl-Cl键和1molH-H键,则吸收能量为436kJ+243kJ=679kJ,生成2molHCl时需生成2molH-Cl键,放出2mol×431KJ/mol=862kJ能量,
放出的能量高于吸收的能量,所以反应是放热的,△H=679kJ/mol-862kJ/mol=-183kJ,即Q=183kJ,
则生成1mol H-Cl时应该放热为$\frac{183kJ}{2}$=91.5kJ,
故选B.
点评 本题考查反应热的计算,为高频考点,把握△H=反应物总键能-生成物总键能是解题关键,注意物质的量与反应放出的热量成正比,题目难度不大.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
6.下列有关物质的性质和应用正确的是( )
| A. | 油脂在酸性条件下水解生成高级脂肪酸和甘油 | |
| B. | 用溴水鉴别苯和正己烷 | |
| C. | 乙醇、糖类和蛋白质都是人体必需的营养物质 | |
| D. | 合成橡胶与光导纤维都属于有机高分子材料 |
14.下列说法中,不正确的是( )
①同一元素的不同核素互称为同位素
②两个非金属元素原子间不可能形成离子键
③金属腐蚀的实质是金属原子失去电子被还原的过程
④因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
⑤元素的非金属性越强,其氧化物对应的水化物的酸性就越强
⑥青铜、不锈钢、硬铝都是合金
⑦Al和Fe在一定条件下都能与某些氧化物反应
⑧化学键可以使离子相结合,也可以使原子相结合.
①同一元素的不同核素互称为同位素
②两个非金属元素原子间不可能形成离子键
③金属腐蚀的实质是金属原子失去电子被还原的过程
④因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
⑤元素的非金属性越强,其氧化物对应的水化物的酸性就越强
⑥青铜、不锈钢、硬铝都是合金
⑦Al和Fe在一定条件下都能与某些氧化物反应
⑧化学键可以使离子相结合,也可以使原子相结合.
| A. | ③④⑤⑦ | B. | ②⑤⑥⑧ | C. | ①③④⑦ | D. | ③④⑤ |
15.下列各组微粒的空间构型相同的是( )
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2⑤CO2和BeCl2 ⑥SiO4-和SO42- ⑦BF3和Al2Cl6.
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2⑤CO2和BeCl2 ⑥SiO4-和SO42- ⑦BF3和Al2Cl6.
| A. | 全部 | B. | 除④⑥⑦以外 | C. | ③④⑤⑥ | D. | ②⑤⑥ |
13.下列图象中的曲线正确的是( )
| A. | 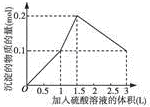 图A表示在1L含0.1mol NaAlO2和0.1mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.11mol•L-1H2SO4溶液,产生沉淀的物质的量与加入硫酸溶液体积的图象 | |
| B. | 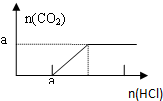 图B表示在分别含amol的Na2CO3和NaOH的混合溶液中逐滴滴加稀盐酸,产生气体 与加入盐酸体积的图象 | |
| C. | 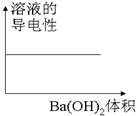 图C表示向100mL 0.1mol/L H2SO4溶液中,逐滴加入0.1mol/L Ba(OH)2溶液至过量, 溶液的导电性与加入 Ba(OH)2溶液体积的图象 | |
| D. | 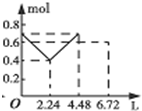 图D表示在往含0.2mol NaOH和0.1mol Ba(OH)2的溶液中持续稳定地通入CO2气体, 溶液中离子数目和通入CO2气体体积的图象(气体的溶解忽略不计) |
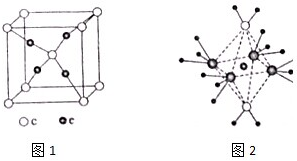 周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子,回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子,回答下列问题: .
.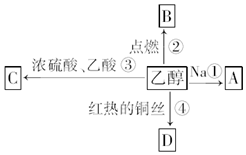 乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是有机物.
乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是有机物.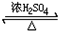 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O