题目内容
4.氢化阿托醛(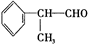 )是一种重要的化工原料,其合成路线如下:
)是一种重要的化工原料,其合成路线如下: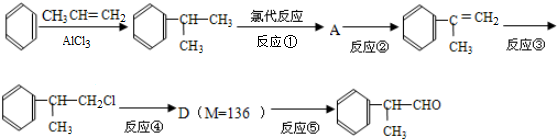
(1)氢化阿托醛被氧化后的含氧官能团的名称是羧基.
(2)在合成路线上②的反应类型为消去反应.
(3)反应④发生的条件是氢氧化钠的水溶液,加热.
(4)由
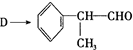 反应的化学方程式为2
反应的化学方程式为2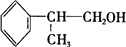 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2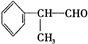 +2H2O.
+2H2O.(5)氢化阿托醛发生银镜反应的方程式为
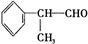 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$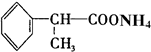 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.
分析 由苯与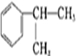 的结构可知,苯和CH3CH=CH2在AlCl3作用下发生加成反应生成
的结构可知,苯和CH3CH=CH2在AlCl3作用下发生加成反应生成 ,与氯气发生取代反应生成氯代烃,结合转化关系可知A为
,与氯气发生取代反应生成氯代烃,结合转化关系可知A为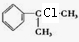 ,由
,由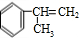 结构可知反应②为消去反应,反应③
结构可知反应②为消去反应,反应③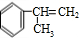 生成
生成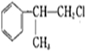 ,C=C键变为C-C键,为
,C=C键变为C-C键,为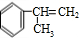 与HCl发生加成反应,D的相对分子质量为136,D在催化剂作用下可被氧化为
与HCl发生加成反应,D的相对分子质量为136,D在催化剂作用下可被氧化为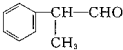 ,说明D中含有-OH,可被氧化,则D应为
,说明D中含有-OH,可被氧化,则D应为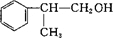 ,则反应④为
,则反应④为 在NaOH水溶液、加热条件下的水解反应生成醇,结合有机物的官能团以及题目要求解答该题.
在NaOH水溶液、加热条件下的水解反应生成醇,结合有机物的官能团以及题目要求解答该题.
解答 解:由苯与 的结构可知,苯和CH3CH=CH2在AlCl3作用下发生加成反应生成
的结构可知,苯和CH3CH=CH2在AlCl3作用下发生加成反应生成 ,与氯气发生取代反应生成氯代烃,结合转化关系可知A为
,与氯气发生取代反应生成氯代烃,结合转化关系可知A为 ,由
,由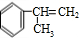 结构可知反应②为消去反应,反应③
结构可知反应②为消去反应,反应③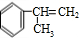 生成
生成 ,C=C键变为C-C键,为
,C=C键变为C-C键,为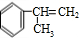 与HCl发生加成反应,D的相对分子质量为136,D在催化剂作用下可被氧化为
与HCl发生加成反应,D的相对分子质量为136,D在催化剂作用下可被氧化为 ,说明D中含有-OH,可被氧化,则D应为
,说明D中含有-OH,可被氧化,则D应为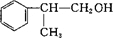 ,则反应④为
,则反应④为 在NaOH水溶液、加热条件下的水解反应生成醇,
在NaOH水溶液、加热条件下的水解反应生成醇,
(1)氢化阿托醛含有醛基,可被氧化生成羧基,故答案为:羧基;
(2)由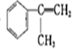 可知反应②为消去反应,故答案为:消去反应;
可知反应②为消去反应,故答案为:消去反应;
(3)反应④为 在NaOH水溶液、加热条件下的水解反应生成
在NaOH水溶液、加热条件下的水解反应生成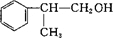 ,故答案为:氢氧化钠的水溶液,加热;
,故答案为:氢氧化钠的水溶液,加热;
(4)D为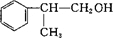 ,D中含有-OH,可被氧化,生成
,D中含有-OH,可被氧化,生成 ,反应的化学方程式为2
,反应的化学方程式为2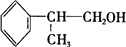 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O,
+2H2O,
故答案为:2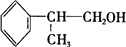 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O;
(5)氢化阿托醛含有醛基,具有还原性,可与银氨溶液发生氧化还原反应,方程式为 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$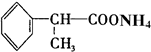 +2Ag↓+3NH3+H2O,故答案为:
+2Ag↓+3NH3+H2O,故答案为: +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$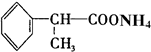 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.
点评 本题考查有机物的合成与推断,为高考常见题型,侧重于学生的分析能力的考查,难度中等,根据有机物的官能团和性质结合反应条件及反应物、生成物的结构特点推断有机物.

 阅读快车系列答案
阅读快车系列答案| A. | 在101 kPa时,1 mol H2完全燃烧生成气态水,放出285.8 kJ热量,H2的燃烧热为285.8 kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| C. | 在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1.若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
| A. | 往鲜榨苹果汁中加入适量柠檬汁防止苹果汁变色 | |
| B. | 做馒头时加一些面碱(Na2CO3)避免馒头发酸 | |
| C. | 采用添加有“光触媒”的硅藻泥做装饰材料,净化室内空气,避免装修污染 | |
| D. | 用汽油洗掉衣物沾上的油渍 |
| A. | S的漂白性 | B. | S的还原性 | C. | SO2的漂白性 | D. | SO2的还原性 |
| A. | 同分异构体因结构不同,化学性质一定差别很大 | |
| B. | 具有相同通式的有机物不一定互为同系物 | |
| C. | 两个相邻同系物的相对分子质量数值一定相差14 | |
| D. | 同分异构体不可能互为同系物 |
| A. | 往反应后的溶液中加入AgNO3溶液检验是否有Br-生成 | |
| B. | 实验中观察不到有气体生成 | |
| C. | 生成的气体可直接通入到溴水中检验是否有乙烯生成 | |
| D. | 生成的气体可直接通入到酸性高锰酸钾溶液中检验是否有乙烯生成 |
| A. | 乙烷 | B. | 乙炔 | C. | 乙烯 | D. | 苯 |
 W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:元素W的一种原子的原子核中没有中子;元素X 构成的某种单质在自然界中硬度最大;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:元素W的一种原子的原子核中没有中子;元素X 构成的某种单质在自然界中硬度最大;元素Z在地壳中含量最高.试回答下列各题: CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.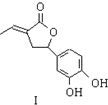 内酯类化合物在药物、涂料等应用广泛.
内酯类化合物在药物、涂料等应用广泛. +$\frac{1}{2}$O2+CO2$\stackrel{催化剂}{→}$
+$\frac{1}{2}$O2+CO2$\stackrel{催化剂}{→}$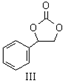
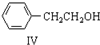 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$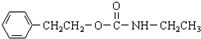 +H2O
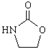
+H2O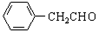 ;由IV生成II的反应条件为浓硫酸、加热.
;由IV生成II的反应条件为浓硫酸、加热. .
. ,涉及的反应方程式为BrCH2CH2-NH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH2NH2、HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$
,涉及的反应方程式为BrCH2CH2-NH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH2NH2、HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$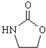 +H2O.
+H2O.