题目内容
13.关于溴乙烷与NaOH的乙醇溶液反应的现象和产物检验,说法正确的是( )| A. | 往反应后的溶液中加入AgNO3溶液检验是否有Br-生成 | |
| B. | 实验中观察不到有气体生成 | |
| C. | 生成的气体可直接通入到溴水中检验是否有乙烯生成 | |
| D. | 生成的气体可直接通入到酸性高锰酸钾溶液中检验是否有乙烯生成 |
分析 溴乙烷与NaOH的乙醇溶液反应,为消去反应,生成乙烯气体、NaBr,若检验溴离子,应先加酸至酸性,再加硝酸银观察是否生成淡黄色沉淀,以此来解答.
解答 解:A.往反应后的溶液中加入AgNO3溶液,不能检验是否有Br-生成,因反应后溶液为碱性,与硝酸银反应,干扰溴离子检验,故A错误;
B.实验中观察到有气体生成,气体为乙烯,故B错误;
C.乙烯与溴水发生加成反应使其褪色,则生成的气体可直接通入到溴水中检验是否有乙烯生成,故C正确;
D.乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化,则生成的气体可直接通入到酸性高锰酸钾溶液中,不能检验是否有乙烯生成,故D错误.
故选C.
点评 本题考查物质的检验和鉴别,为高频考点,把握卤代烃的消去反应及水解产物的检验方法为解答的关键,注意溴离子检验及选项D为解答的易错点,题目难度不大.

练习册系列答案
相关题目
5.化学与生产、生活密切相关.下列与化学有关的事实及其相关化学方程式的书写都正确的是( )
| 选项 | 事实 | 化学方程式 |
| A | 常温下,可用铝制容器盛放浓硝酸 | A l+3HNO3(浓)=Al(OH)3+3NO2↑ |
| B | 可用生石灰做工业废气脱硫酸 | 2CaO+2SO2+O2=2CaSO4 |
| C | 电解MgCl2溶液冶炼Mg | MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ |
| D | 侯德榜用饱和食盐水、氨水、CO2制备纯碱 | 2NaCl+2NH3+CO2+H2O=2NH4Cl+NaCO3 |
| A. | A | B. | B | C. | C | D. | D |
1.分子式为C5H120且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)( )
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
8.关于下图所示转化关系(X代表卤素),说法不正确的是( )
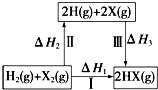

| A. | 2H(g)+2X(g)═2HX(g)△H3<0 | |
| B. | 生成HX的反应热与途径无关,所以△H1=△H2+△H3 | |
| C. | F、Cl、Br的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多 | |
| D. | F2、Cl2分别发生反应I,同一温度下的平衡常数分别为K1、K2,则K1>K2 |
18.分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)( )
| A. | 3种 | B. | 5种 | C. | 8种 | D. | 9种 |
2.将KO2放人密闭的真空容器中,一定条件下,发生反应:4KO2(s)?2K2O(s)+3O2(g),达到平衡后,保持温度不变,缩小容器体积,重新达到平衡.下列说法正确的是( )
| A. | 容器内压强增大 | B. | KO2的量保持不变 | C. | 平衡常数减小 | D. | 氧气浓度不变 |
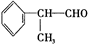 )是一种重要的化工原料,其合成路线如下:
)是一种重要的化工原料,其合成路线如下: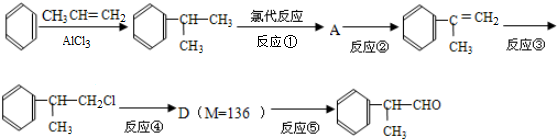
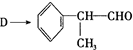 反应的化学方程式为2
反应的化学方程式为2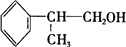 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2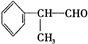 +2H2O.
+2H2O.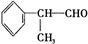 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$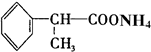 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.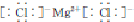 ,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能.
,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能.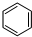 (g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$
(g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$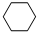 (g)
(g)