题目内容
12.下列说法正确的是( )| A. | 在101 kPa时,1 mol H2完全燃烧生成气态水,放出285.8 kJ热量,H2的燃烧热为285.8 kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| C. | 在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1.若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
分析 A.依据燃烧热概念分析判断;
B.中和热测定时,必须测定起始温度和反应最高温度;
C.燃烧热是C燃烧生成CO2时放出的热量;
D.根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量分析.
解答 解:A.燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,强调可燃物为1mol,生成物是稳定的氧化物,在101 kPa时,1 molH2完全燃烧生成气态水不是稳定的氧化物,故A错误;
B.中和热测定时,必须测定起始温度和反应后温度,即反应开始前酸和碱的温度,反应后的最高温度,酸碱中和反应为放热反应,所以反应后温度一定为最高温度,故B正确;
C.C的燃烧热是C完全燃烧生成CO2时放出的热量,故C错误;
D.浓硫酸溶解时放热,0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ,故D错误;
故选B.
点评 本题考查燃烧热、中和热的应用,注意准确理解概念中的关键词是解答关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.分子式为C4H9ClO的有机物,能与金属钠反应放出氢气的同分异构体数目有( )
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
5.化学与生产、生活密切相关.下列与化学有关的事实及其相关化学方程式的书写都正确的是( )
| 选项 | 事实 | 化学方程式 |
| A | 常温下,可用铝制容器盛放浓硝酸 | A l+3HNO3(浓)=Al(OH)3+3NO2↑ |
| B | 可用生石灰做工业废气脱硫酸 | 2CaO+2SO2+O2=2CaSO4 |
| C | 电解MgCl2溶液冶炼Mg | MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ |
| D | 侯德榜用饱和食盐水、氨水、CO2制备纯碱 | 2NaCl+2NH3+CO2+H2O=2NH4Cl+NaCO3 |
| A. | A | B. | B | C. | C | D. | D |
2.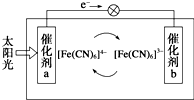 一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
 一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )| A. | K+移向催化剂b | |
| B. | 催化剂a表面发生的化学反应:[Fe(CN)6]4--e-═[Fe(CN)6]3- | |
| C. | Fe(CN)63-在催化剂b表面被氧化 | |
| D. | 电解池溶液中的[Fe(CN)6]4-和[Fe(CN)6]3-浓度基本保持不变 |
7.和醛基相邻的碳原子上的氢叫α氢.没有α氢的醛在浓的强碱作用下发生分子间氧化还原反应生成羧酸和醇,叫做康尼查罗反应.例如:2HCHO+NaOH→CH3OH+HCOONa.下列化合物中,不能发生康尼查罗反应的是( )
| A. | 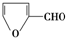 | B. |  | C. | (CH3)3CCHO | D. | CH3CHO |
17.下列说法正确的是( )
| A. | 等质量的硫蒸汽和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | 由C(金刚石)═C(石墨)△H=-1.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | NH3的稳定性强,是因为其分子之间存在氢键 |
1.分子式为C5H120且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)( )
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
2.将KO2放人密闭的真空容器中,一定条件下,发生反应:4KO2(s)?2K2O(s)+3O2(g),达到平衡后,保持温度不变,缩小容器体积,重新达到平衡.下列说法正确的是( )
| A. | 容器内压强增大 | B. | KO2的量保持不变 | C. | 平衡常数减小 | D. | 氧气浓度不变 |
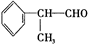 )是一种重要的化工原料,其合成路线如下:
)是一种重要的化工原料,其合成路线如下: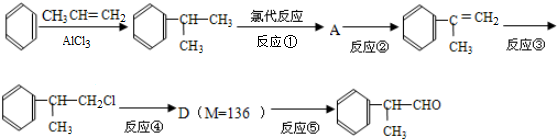
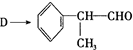 反应的化学方程式为2
反应的化学方程式为2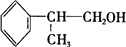 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2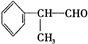 +2H2O.
+2H2O.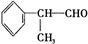 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$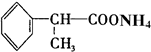 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.