题目内容
7.高温下,炽热的铁与水蒸气在密闭容器中进行反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是( )| A. | 增加H2的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 压强不变,充入氮气使容器体积增大 | |
| D. | 体积不变,充入氮气使容器压强增大 |
分析 对于3Fe(s)+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4(s)+4H2(g)来说,增大压强、浓度、升高温度以及增大固体的表面积,都可增大反应速率,以此解答.
解答 解:A.增加H2的量,即增大生成物浓度,则反应速率增大,故A不选;
B.将容器的体积缩小一半,气体浓度增大,反应速率增大,故B不选;
C.压强不变,充入氮气使容器体积增大,则容器体积应增大,气体浓度减小,反应速率减小,故C不选;
D.体积不变,充入氮气使容器压强增大,反应物和生成物浓度不变,则反应速率不变,故D选.
故选D.
点评 本题考查化学反应速率,为高频考点,侧重于学生的分析能力和基本理论、概念的综合理解和运用的考查,难度不大,注意相关基础知识的积累,易错点为C,注意压强与浓度的关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.β-紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1.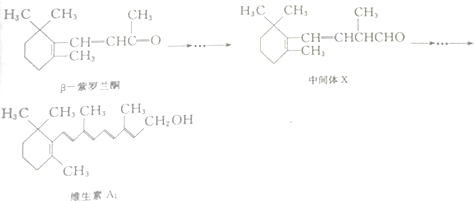
下列说法正确的是( )

下列说法正确的是( )
| A. | β-紫罗兰酮在核磁共振氢谱图中有7组峰 | |
| B. | β-紫罗兰酮与中间体X互为同分异构体 | |
| C. | 1mol中间体X最多能与2mol H2发生加成反应 | |
| D. | 维生素A1能发生取代反应、加成反应和氧化反应 |
18.高温下,某反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| A. | 该反应是焓变为负值 | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应化学方程式为CO2(g)+H2(g) $?_{高温}^{催化剂}$ CO(g)+H2O(g) |
12.下图是元素周期表的一部分,表中的①~⑧中元素,用 元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为
(2)地壳中含量最多的元素是O.
(3)②与④的单质在加热条件下反应生成一种淡黄色固体,该固体的电子式为 .
.
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3.(填具体物质化学式)
(5)写出⑤的单质与氢氧化钠溶液反应的离子方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |

(2)地壳中含量最多的元素是O.
(3)②与④的单质在加热条件下反应生成一种淡黄色固体,该固体的电子式为
 .
.(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3.(填具体物质化学式)
(5)写出⑤的单质与氢氧化钠溶液反应的离子方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
16.下列关于苯的叙述中错误的是( )
| A. | 苯的硝化反应是取代反应 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡并静置后下层液体为紫色 | |
| C. | 78g苯(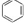 )中含有C=C双键的数目为3NA )中含有C=C双键的数目为3NA | |
| D. | 在一定条件下,苯能与氢气发生加成反应 |
17.在0.1mol•L-1的CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入少量NaOH固体,平衡正向移动,溶液中c(H+)增大 | |
| B. | 加水,平衡正向移动,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| C. | 通入少量HCl,平衡逆向移动,溶液中c(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡逆向移动,溶液导电能力减弱 |
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O. 在浓硫酸作用下,与浓硝酸反应的化学方程式为:C6H6+HNO3$→_{50℃-60℃}^{浓硫酸}$C6H5NO2+H2O.
在浓硫酸作用下,与浓硝酸反应的化学方程式为:C6H6+HNO3$→_{50℃-60℃}^{浓硫酸}$C6H5NO2+H2O. .
.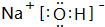 或
或 等,一种共价化合物的电子式为
等,一种共价化合物的电子式为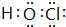 等.
等.