题目内容
17.在0.1mol•L-1的CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )| A. | 加入少量NaOH固体,平衡正向移动,溶液中c(H+)增大 | |
| B. | 加水,平衡正向移动,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| C. | 通入少量HCl,平衡逆向移动,溶液中c(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡逆向移动,溶液导电能力减弱 |
分析 A、醋酸溶液中组存在电离平衡,加入碱促进电离;
B、加水稀释促进电离;
C、通入少量HCl,氢离子浓度变大平衡逆向移动;
D、醋酸钠溶解后醋酸根离子抑制醋酸的电离,但自由移动离子浓度变大.
解答 解:A、加入少量NaOH固体,氢离子浓度减小,加入碱促进电离,平衡正向移动,故A错误;
B、加水稀释促进电离,所以平衡正向移动,醋酸浓度减小,醋根离子浓度变大,所以$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小,故B正确;
C、通入少量HCl,氢离子浓度变大,平衡逆向移动,故C错误;
D、醋酸钠溶解后醋酸根离子抑制醋酸的电离,但自由移动离子浓度变大,溶液导电能力增强,故D错误;
故选B.
点评 本题考查了弱电解质电离平衡的影响因素分析和平衡移动方向的判断,电离是吸热过程,酸碱盐的影响分析是解题关键.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
7.高温下,炽热的铁与水蒸气在密闭容器中进行反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是( )
| A. | 增加H2的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 压强不变,充入氮气使容器体积增大 | |
| D. | 体积不变,充入氮气使容器压强增大 |
8.铝热反应生成的铁常因其中含有铝而形成合金.一定质量的铁铝合金溶于足量的NaOH溶液中,完全反应后产生6.72L(标准状况下)气体;用同样质量的铁铝合金完全溶于足量的盐酸中,在标准状况下产生17.92L气体.则该合金中铝、铁的物质的量之比为( )
| A. | 1:1 | B. | 2:5 | C. | 3:2 | D. | 3:5 |
5.甲基苯基甲醇(Methylphenylcarbinol)可以用作食用香精,其结构简式为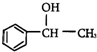 则甲基苯基甲醇的分子式为( )
则甲基苯基甲醇的分子式为( )
 则甲基苯基甲醇的分子式为( )
则甲基苯基甲醇的分子式为( )| A. | C8H10O | B. | C9H10O | C. | C8H8O | D. | C8H12O |
12.下列过程中,破坏的作用力相同的是( )
| A. | HCl溶于水和NaCl溶于水 | B. | 干冰升华和碘升华 | ||
| C. | NH4Cl受热分解和HI受热分解 | D. | 石英熔化和冰熔化 |
7.下列有关说法正确的是( )
| A. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H<0,升高温度,反应速率v(H2 )和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
 已知A、B、C、D和E均为元素周期表中前四周期的元素,它们的原子序数依次增大.A是原子半径最小的元素.B和C形成的-1价阴离子最外层均为8电子,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.请回答:
已知A、B、C、D和E均为元素周期表中前四周期的元素,它们的原子序数依次增大.A是原子半径最小的元素.B和C形成的-1价阴离子最外层均为8电子,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.请回答: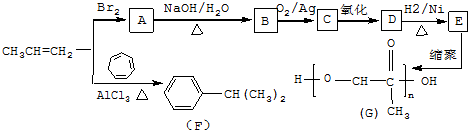
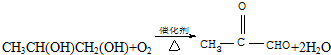 ,C发生银镜反应的化学方程式
,C发生银镜反应的化学方程式 .
.