题目内容
12.下图是元素周期表的一部分,表中的①~⑧中元素,用 元素符号或化学式填空回答:族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |

(2)地壳中含量最多的元素是O.
(3)②与④的单质在加热条件下反应生成一种淡黄色固体,该固体的电子式为
 .
.(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3.(填具体物质化学式)
(5)写出⑤的单质与氢氧化钠溶液反应的离子方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
分析 由元素在周期表中的位置可知,①为N,②为O,③为F,④为Na,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,
(1)在这些元素中,化学性质最不活泼的为稀有气体元素Ar;
(2)根据地壳中元素的含量判断;
(3)②与④的单质在加热条件下反应生成一种淡黄色固体,为过氧化钠;
(4)根据元素的非金属性越强,最高价氧化物对应的水化物的酸性越强,元素的金属性越强,最高价氧化物对应的水化物的碱性越强,据此判断;
(5)⑤的单质为铝,与氢氧化钠溶液反应生成氢气和偏铝酸钠;
解答 解:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,
(1)以上元素中只有Ar的最外层电子数为8,性质不活泼,最稳定,其原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)地壳中元素的含量较多的有O、Si、Al、Ca,则地壳中含量最多的元素是O,故答案为:O;
(3)②与④形成的化合物为Na2O2,为离子化合物,其电子式为 ,故答案为:
,故答案为: ;
;
(4)以上元素中最高价氧化物对应的水化物中酸性最强的为HClO4,碱性最强的为NaOH,呈两性的氢氧化物为Al(OH)3,故答案为:HClO4;NaOH;Al(OH)3;
(5)⑤为Al,与NaOH溶液反应生成偏铝酸钠和氢气,反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 本题考查元素周期表和元素周期律,熟悉元素在周期表中的位置是解答本题的关键,难度不大,注意化学用语的使用来解答.

练习册系列答案
相关题目
3.下表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成物质F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: .
.
(4)据报道,最近摩托罗拉公司研制了一种由有机物C的同系物(该有机物的碳原子数比有机物C的碳原子数少1)和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍.该燃料电池的负极上的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,当外电路通过1.2mol e-时,理论上消耗该有机物为6.4g.
| A | ①能使溴的四氯化碳溶液褪色;②比例模型为 ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与E反应生成相对分子质量为100的酯 |
| D | ①相对分子质量比C少2;②能由C氧化而成. |
| E | ①由C、H、O三种元素组成;②球棍模型为 |
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成物质F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(4)据报道,最近摩托罗拉公司研制了一种由有机物C的同系物(该有机物的碳原子数比有机物C的碳原子数少1)和氧气以及强碱作电解质溶液的新型手机电池,电量可达现用镍氢电池或锂电池的10倍.该燃料电池的负极上的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,当外电路通过1.2mol e-时,理论上消耗该有机物为6.4g.
20.为达到下列实验目的,所选试剂不足的是( )
| 选项 | 实验目的 | 选用试剂 |
| A | 探究Cl2、Br2、I2的氧化性强弱顺序 | 氯水、溴水、KI溶液 |
| B | 探究化学反应的能量变化 | Ba(OH)2•8H2O、NH4Cl晶体 |
| C | 证明海带灰中含有碘元素 | 海带灰、稀硫酸、3%的H2O2溶液、淀粉溶液 |
| D | 证明淀粉是否水解 | 淀粉溶液、稀硫酸、NaOH溶液、银氨溶液 |
| A. | A | B. | B | C. | C | D. | D |
7.高温下,炽热的铁与水蒸气在密闭容器中进行反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是( )
| A. | 增加H2的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 压强不变,充入氮气使容器体积增大 | |
| D. | 体积不变,充入氮气使容器压强增大 |
17.下列有关铵盐的叙述中,不正确的是( )
| A. | 铵盐都易溶于水 | |
| B. | 由于易溶,Na+、K+、NH4+都不可能在相关离子方程式中出现 | |
| C. | NH4Cl的分解与NH3、HCl的化合不属于可逆反应 | |
| D. | 铵盐都能与NaOH反应 |
4.据报道,一种“月球制氧机”可利用聚焦太阳能产生的高温加热月球土壤,制得氧气.据此可推测月球土壤中一定含有( )
| A. | 氧化物 | B. | 氧气 | C. | 水 | D. | 氧元素 |
1.下列措施能减慢H2O2分解速率,有利于双氧水长时间保存的是( )
| A. | 放在无色透明细口瓶中 | B. | 置于冷暗处 | ||
| C. | 置于通风透光处 | D. | 加入少量MnO2或FeCl3溶液 |
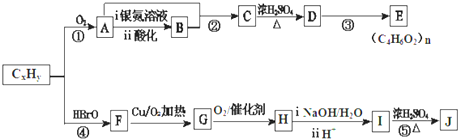

 .
.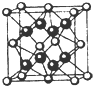 已知A、B、C、D和E均为元素周期表中前四周期的元素,它们的原子序数依次增大.A是原子半径最小的元素.B和C形成的-1价阴离子最外层均为8电子,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.请回答:
已知A、B、C、D和E均为元素周期表中前四周期的元素,它们的原子序数依次增大.A是原子半径最小的元素.B和C形成的-1价阴离子最外层均为8电子,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如图.请回答: