题目内容
【题目】CO2是地球上取之不尽用之不竭的碳源,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)CO2加氢制备甲酸(HCOOH,熔点8.4℃沸点100.8℃)是利用化学载体进行H2储存的关键步骤。
已知:H2(g)+CO2(g)![]() HCOOH(l) △H1=-30.0kJmol-1
HCOOH(l) △H1=-30.0kJmol-1
2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJmol-1
则表示HCOOH燃烧热的热化学方程式为___。
(2)在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
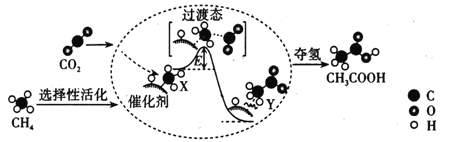
①在合成CH3COOH的反应历程中,下列有关说法正确的是___。填(字母)
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为___。
(3)CO2与H2在一定条件下反应可生成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
反应时间 | n(CO2)/mol | n(H2)/mol | n(CH3OH)/mol | n(H2O)/mol | |
实验I恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
实验II绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①实验I,前10min内的平均反应速率υ(CH3OH)=___。
②平衡时CH3OH的浓度:c(实验I)___c(实验II)(填“>”、“<”或“=”,下同)。实验I中当其他条件不变时,若30min后只改变温度为T2℃,再次平衡时n(H2)=3.2mol,则T1___T2。
③已知某温度下该反应的平衡常数K=160,开始时在密闭容器中只加入CO2和H2,反应10min时测得各组分的浓度如下表,则此时υ正___υ逆。
物质 | H2 | CO2 | CH3OH | H2O |
浓度/(mol·L-1) | 0.2 | 0.2 | 0.4 | 0.4 |
【答案】HCOOH(1)+![]() O2(g)=CO2(g)+H2O(1) △H=-255.8kJ·mol-1 bc CH4+CO2
O2(g)=CO2(g)+H2O(1) △H=-255.8kJ·mol-1 bc CH4+CO2![]() CH3COOH 0.025molL-1·min-1 < < >
CH3COOH 0.025molL-1·min-1 < < >
【解析】
(1)①H2(g)+CO2(g)![]() HCOOH(l) △H1=-30.0kJmol-1
HCOOH(l) △H1=-30.0kJmol-1
②2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJmol-1
根据盖斯定律:②×![]() -①得:HCOOH(1)+
-①得:HCOOH(1)+![]() O2(g)=CO2(g)+H2O(1) △H=
O2(g)=CO2(g)+H2O(1) △H= ![]() ×(-571.6kJmol-1)-(-30.0kJmol-1)=-255.8kJ·mol-1,表示CH3COOH燃烧热的热化学方程式为HCOOH(1)+
×(-571.6kJmol-1)-(-30.0kJmol-1)=-255.8kJ·mol-1,表示CH3COOH燃烧热的热化学方程式为HCOOH(1)+![]() O2(g)=CO2(g)+H2O(1) △H=-255.8kJ·mol-1,故答案为:HCOOH(1)+
O2(g)=CO2(g)+H2O(1) △H=-255.8kJ·mol-1,故答案为:HCOOH(1)+![]() O2(g)=CO2(g)+H2O(1) △H=-255.8kJ·mol-1;
O2(g)=CO2(g)+H2O(1) △H=-255.8kJ·mol-1;
(2)①a.催化剂改变反应速率,不影响平衡,反应的平衡常数不变,故错误;
b.CH4→CH3COOH过程中,第一步甲烷与二氧化碳中的C=O双键发生加成反应,有C—H键发生断裂,故正确;
c.由X→Y过程中,甲烷的碳与二氧化碳中有碳相连,形成了C—C键并放出能量,故正确;
故答案为:bc;
②该条件下甲烷与二氧化碳中的C=O双键发生加成反应,甲烷的碳与二氧化碳中有碳相连,氢原子与氧原子相连,由CO2和CH4合成CH3COOH的化学方程式为CH4+CO2![]() CH3COOH,故答案为:CH4+CO2
CH3COOH,故答案为:CH4+CO2![]() CH3COOH;
CH3COOH;
(3)①实验I,前10min内的平均反应速率υ(H2)=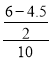 mol/(L·min)=0.075mol/(L·min),υ(CH3OH)=
mol/(L·min)=0.075mol/(L·min),υ(CH3OH)=![]() υ(H2)=0.025molL-1·min-1,故答案为:0.025molL-1·min-1;
υ(H2)=0.025molL-1·min-1,故答案为:0.025molL-1·min-1;
②如果条件相同,实验I和II是等效平衡,但实验II逆向进行,吸收热量,平衡时温度低,与实验I相比,相当于降温,平衡正向移动,平衡时CH3OH的浓度:c(实验I)<c(实验II)。实验I在30min达到平衡时,n(H2)=6mol-3mol=3mol,实验I中当其他条件不变时,若30min后只改变温度为T2℃,再次平衡时n(H2)=3.2mol,说明平衡逆向移动,该反应为放热反应,则T1<T2。故答案为:<;<;
③Qc=![]() =100<K=160,反应正向进行,则此时υ正>υ逆。
=100<K=160,反应正向进行,则此时υ正>υ逆。
故答案为:>。

【题目】下列各组中离子在水溶液中能大量共存且满足相应要求的是( )
选项 | 离子 | 要求 |
A | K+、NO | c(K+)<c(Cl-) |
B | Na+、NO | 逐滴滴加盐酸立即有气体产生 |
C | Na+、Al3+、Mg2+、SO | 逐滴滴加氨水立即有沉淀产生 |
D | NH | 滴加NaOH浓溶液立刻有气体产生 |
A.AB.BC.CD.D