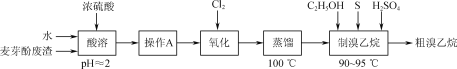
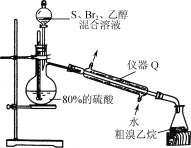
题目内容
【题目】ClO2广泛用于水处理、纸浆漂白等。
(1)制备ClO2原料有NaClO2等,产生的ClO2(g)用蒸馏水吸收得到吸收液A。
①ClO2中氯元素的化合价为___。
②NaClO2与盐酸在微热条件下生成ClO2气体(及少量副产物Cl2),写出其反应生成ClO2、NaCl和水的化学方程式:___。
(2)碘量法测定ClO2吸收液A中ClO2和Cl2的浓度的主要实验步骤如下:
步骤1.向锥形瓶中加入50mL蒸馏水、25mL100g·L-1KI溶液(足量),再向其中加入5.00mLClO2吸收液(发生反应:2ClO2+2KI=2KClO2+I2,Cl2+2KI=2KCl+I2)。
步骤2.用0.1000mol·L-1Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)至浅黄色,再加入1mL淀粉溶液,继续滴定至蓝色刚好消失,消耗Na2S2O3溶液6.00mL。
步骤3.向步骤2的溶液中加入5mL2mol·L-1硫酸溶液酸化,发生反应:KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O。
步骤4.重复步骤2操作,第二次滴定又消耗0.1000mol·L-1Na2S2O3溶液20.00mL。
根据上述数据,计算ClO2吸收液A中ClO2和Cl2的浓度___(单位g·L-1,写出计算过程)。
【答案】+4 5NaClO2+4HCl![]() 4ClO2↑+5NaCl+2H2O 令5.00mLClO2吸收液中,n(ClO2)=xmol,n(Cl2)=ymol,由反应方程式可知,2ClO2+2KI=2KClO2+I2,Cl2+2KI=2KCl+I2,n(KClO2)=n(ClO2)=xmol,n(I2)=
4ClO2↑+5NaCl+2H2O 令5.00mLClO2吸收液中,n(ClO2)=xmol,n(Cl2)=ymol,由反应方程式可知,2ClO2+2KI=2KClO2+I2,Cl2+2KI=2KCl+I2,n(KClO2)=n(ClO2)=xmol,n(I2)=![]() n(ClO2)+n(Cl2)=(
n(ClO2)+n(Cl2)=(![]() x+y) mol,根据反应方程式2Na2S2O3+I2=2NaI+Na2S4O6,n(I2)=
x+y) mol,根据反应方程式2Na2S2O3+I2=2NaI+Na2S4O6,n(I2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×0.1000mol·L-1×6.00×10-3L=3×10-4mol=(
×0.1000mol·L-1×6.00×10-3L=3×10-4mol=(![]() x+y) mol;根据反应方程式KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,列出关系式KClO2 ~ 2I2 ~ 4Na2S2O3,n(KClO2)=
x+y) mol;根据反应方程式KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,列出关系式KClO2 ~ 2I2 ~ 4Na2S2O3,n(KClO2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×0.1000mol·L-1×20.00×10-3L=5×10-4mol,因为n(KClO2)=n(ClO2)=xmol,所以x=5.0×10-4,又因为3×10-4=
×0.1000mol·L-1×20.00×10-3L=5×10-4mol,因为n(KClO2)=n(ClO2)=xmol,所以x=5.0×10-4,又因为3×10-4=![]() (x+y),y=5.0×10-5,故5.00mLClO2吸收液中ClO2和Cl2的浓度分别为为
(x+y),y=5.0×10-5,故5.00mLClO2吸收液中ClO2和Cl2的浓度分别为为![]() 、
、
![]() 。
。
【解析】
利用化合物中元素化合价代数和为0,确定ClO2中氯元素的化合价;2ClO2+2KI=2KClO2+I2,Cl2+2KI=2KCl+I2,根据题中的数据和已知方程式,找出n(KClO2)=n(ClO2)、n(I2)=![]() n(ClO2)+n(Cl2),再根据反应方程式2Na2S2O3+I2=2NaI+Na2S4O6,n(I2)=
n(ClO2)+n(Cl2),再根据反应方程式2Na2S2O3+I2=2NaI+Na2S4O6,n(I2)=![]() n(ClO2)+n(Cl2)=
n(ClO2)+n(Cl2)=![]() n(Na2S2O3),最后根据反应方程式KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O,找出n(KClO2)=
n(Na2S2O3),最后根据反应方程式KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O,找出n(KClO2)=![]() n(Na2S2O3),把两次用到的Na2S2O3的物质的量代入计算,即可计算出ClO2和Cl2的物质的量。
n(Na2S2O3),把两次用到的Na2S2O3的物质的量代入计算,即可计算出ClO2和Cl2的物质的量。
(1)①ClO2中氧元素的化合价为-2价,根据化合物中元素化合价代数和为0,则ClO2中氯元素的化合价为+4价;
②NaClO2与盐酸在微热条件下反应生成ClO2、NaCl和水,该反应为氧化还原反应,根据氧化还原反应中得失电子守恒配平方程式,其方程式为5NaClO2+4HCl![]() 4ClO2↑+5NaCl+2H2O;
4ClO2↑+5NaCl+2H2O;
(2)令5.00mLClO2吸收液中,n(ClO2)=xmol,n(Cl2)=ymol,由反应方程式2ClO2+2KI=2KClO2+I2,Cl2+2KI=2KCl+I2可知n(KClO2)=n(ClO2)=xmol,n(I2)=![]() n(ClO2)+n(Cl2)=(
n(ClO2)+n(Cl2)=(![]() x+y) mol,根据反应方程式2Na2S2O3+I2=2NaI+Na2S4O6,n(I2)=
x+y) mol,根据反应方程式2Na2S2O3+I2=2NaI+Na2S4O6,n(I2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×0.1000mol·L-1×6.00×10-3L=3×10-4mol=
×0.1000mol·L-1×6.00×10-3L=3×10-4mol=
(![]() x+y) mol;根据反应方程式KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,列出关系式KClO2 ~ 2I2 ~ 4Na2S2O3,n(KClO2)=
x+y) mol;根据反应方程式KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,列出关系式KClO2 ~ 2I2 ~ 4Na2S2O3,n(KClO2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×0.1000mol·L-1×20.00×10-3L=5×10-4mol,因为n(KClO2)=n(ClO2)=xmol,所以x=5.0×10-4,又因为3×10-4=
×0.1000mol·L-1×20.00×10-3L=5×10-4mol,因为n(KClO2)=n(ClO2)=xmol,所以x=5.0×10-4,又因为3×10-4=![]() (x+y),y=5.0×10-5,故5.00mLClO2吸收液中ClO2的浓度为
(x+y),y=5.0×10-5,故5.00mLClO2吸收液中ClO2的浓度为
![]() ,5.00mLClO2吸收液中Cl2的浓度为
,5.00mLClO2吸收液中Cl2的浓度为![]() 。
。

【题目】CO2是地球上取之不尽用之不竭的碳源,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)CO2加氢制备甲酸(HCOOH,熔点8.4℃沸点100.8℃)是利用化学载体进行H2储存的关键步骤。
已知:H2(g)+CO2(g)![]() HCOOH(l) △H1=-30.0kJmol-1
HCOOH(l) △H1=-30.0kJmol-1
2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJmol-1
则表示HCOOH燃烧热的热化学方程式为___。
(2)在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
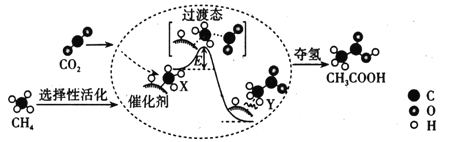
①在合成CH3COOH的反应历程中,下列有关说法正确的是___。填(字母)
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为___。
(3)CO2与H2在一定条件下反应可生成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
反应时间 | n(CO2)/mol | n(H2)/mol | n(CH3OH)/mol | n(H2O)/mol | |
实验I恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
实验II绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①实验I,前10min内的平均反应速率υ(CH3OH)=___。
②平衡时CH3OH的浓度:c(实验I)___c(实验II)(填“>”、“<”或“=”,下同)。实验I中当其他条件不变时,若30min后只改变温度为T2℃,再次平衡时n(H2)=3.2mol,则T1___T2。
③已知某温度下该反应的平衡常数K=160,开始时在密闭容器中只加入CO2和H2,反应10min时测得各组分的浓度如下表,则此时υ正___υ逆。
物质 | H2 | CO2 | CH3OH | H2O |
浓度/(mol·L-1) | 0.2 | 0.2 | 0.4 | 0.4 |
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)写出H2C2O4溶液和酸性KMnO4溶液反应的离子方程式___________;
(2)探究温度对化学反应速率影响的实验编号是_____(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是_____;
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率υ(KMnO4)=_____mol/(L·min);
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图________。