题目内容
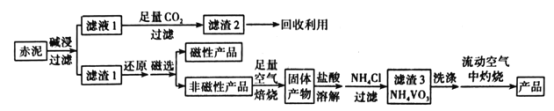
【题目】一定条件下,向一密闭容器中充入一定量的NH3,反应2NH3(g)![]() N2(g)+3H2(g)达到平衡时N2的体积分数与温度、压强的关系如图所示。下列说法正确的是
N2(g)+3H2(g)达到平衡时N2的体积分数与温度、压强的关系如图所示。下列说法正确的是

A. 压强:p1>p2
B. b、c两点对应的平衡常数:Kc>Kb
C. a点:2v(NH3)正=3v(H2)逆
D. a点:NH3的转化率为1/3
【答案】B
【解析】
A. 同一温度下,增大压强,平衡向逆反应方向移动,N2的体积分数将减小;
B. 根据热效应判断平衡常数与温度的关系;
C. 各物质的化学反应速率之比等于参加反应的化学计量数之比;
D. 设反应前氨气的物质的量为1mol,利用图像信息结合转化率定义作答。
A.同一温度下,压强越大,N2的体积分数越小,根据图像可知,p1<p2,A项错误;
B.b、c两点对应温度b<c,该反应为吸热反应,温度越高,平衡常数越大,Kc>Kb,B项正确;
C.速率之比等于化学计量数之比,3v(NH3)正=2v(H2)逆,C项错误;
D.对于反应2NH3(g) ![]() N2(g)+3H2(g),假设反应前氨气的物质的量为1mol,反应的氨气等于反应减少的气体的物质的量,设反应的氨气的物质的量为x,则
N2(g)+3H2(g),假设反应前氨气的物质的量为1mol,反应的氨气等于反应减少的气体的物质的量,设反应的氨气的物质的量为x,则![]() =0.1,解得x=
=0.1,解得x=![]() ,因此氨气的转化率为
,因此氨气的转化率为![]() ,D项错误;
,D项错误;
答案选B。

【题目】CO2是地球上取之不尽用之不竭的碳源,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)CO2加氢制备甲酸(HCOOH,熔点8.4℃沸点100.8℃)是利用化学载体进行H2储存的关键步骤。
已知:H2(g)+CO2(g)![]() HCOOH(l) △H1=-30.0kJmol-1
HCOOH(l) △H1=-30.0kJmol-1
2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJmol-1
则表示HCOOH燃烧热的热化学方程式为___。
(2)在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
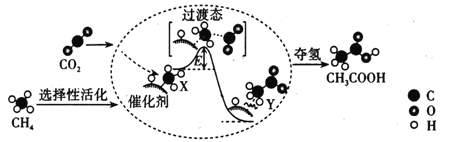
①在合成CH3COOH的反应历程中,下列有关说法正确的是___。填(字母)
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为___。
(3)CO2与H2在一定条件下反应可生成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
反应时间 | n(CO2)/mol | n(H2)/mol | n(CH3OH)/mol | n(H2O)/mol | |
实验I恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
实验II绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①实验I,前10min内的平均反应速率υ(CH3OH)=___。
②平衡时CH3OH的浓度:c(实验I)___c(实验II)(填“>”、“<”或“=”,下同)。实验I中当其他条件不变时,若30min后只改变温度为T2℃,再次平衡时n(H2)=3.2mol,则T1___T2。
③已知某温度下该反应的平衡常数K=160,开始时在密闭容器中只加入CO2和H2,反应10min时测得各组分的浓度如下表,则此时υ正___υ逆。
物质 | H2 | CO2 | CH3OH | H2O |
浓度/(mol·L-1) | 0.2 | 0.2 | 0.4 | 0.4 |