题目内容
4.铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:(1)亚铜离子(Cu+)基态时的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10.
(2)Cu晶体的堆积方式是面心立方最密堆积(或A1),其配位数为12;
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是AD.
A.[Cu(NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Cu(NH3)4]2+中Cu2+给出孤电子对,NH3提供空轨道
C.[Cu(NH3)4]SO4组成元素中第一电离能最大的是氧元素
D.SO42-与PO43- 互为等电子体,空间构型均为正四面体
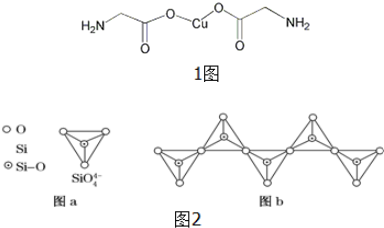
(4)氨基乙酸铜的分子结构如图1,碳原子的杂化方式为sp2、sp3.该分子中σ键与π键个数比值为9:1.
(5)在硅酸盐中,SiO${\;}_{4}^{4-}$四面体(如图2a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图2b为一种无限长单链结构的多硅酸根,Si与O的原子数之比为1:3,化学式为SiO32-(或(SiO3)n2n-.
分析 (1)Cu原子失去4s能级1个电子形成亚铜离子;
(2)Cu晶体的堆积方式是面心立方最密堆积,配位数为12;
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,为配合物,其中Cu2+提供空轨道,NH3提供孤电子对;
(4)根据碳原子的成键情况要以判断碳原子的杂化方式;分子中含有2个π键,其它为σ键;
(5)SiO44-中价层电子对个数是4且不含孤电子对,利用均摊法计算其原子个数比,从而确定其化学式.
解答 解:(1)Cu原子失去4s能级1个电子形成亚铜离子,基态时亚铜离子核外电子排布式为为:1s22s22p63s23p63d10或[Ar]3d10,
故答案为:1s22s22p63s23p63d10或[Ar]3d10;
(2)Cu晶体的堆积方式是面心立方最密堆积,在金属晶体的最密堆积中,对于每个原子来说,在其周围的原子有与之同一层上有六个原子和上一层的三个及下一层的三个,故每个原子周围都有12个原子与之相连,
故答案为:面心立方最密堆积(或A1);12;
(3)A.[Cu(NH3)4]SO4为离子化合物,含有离子键,存在N-H极性键以及Cu-N配位键,故A正确;
B.在[Cu(NH3)4]2+中Cu2+提供空轨道,NH3提供孤电子对,故B错误;
C.[Cu(NH3)4]SO4组成元素中第一电离能最大的是N元素,最外层为半充满状态,故C错误;
D.SO42-与PO43- 互为等电子体,结构相似,中心原子形成4个σ键,空间构型均为正四面体,故D正确.
故答案为:A D;
(4)氨基乙酸铜的分子中存在C=O键,碳的杂化方式为sp2杂化,含有饱和碳原子,碳的杂化方式为sp3杂化;分子中含有4个N-H键、4个C-H键,2个C-N键、2个C-C键、2个C-O键,2个0-Cu键,以及2个C=O键,则共含有18个σ键,2个π键,该分子中σ键与π键个数比值为9:1,
故答案为:sp2、sp3;9:1;
(5)根据图片知,每个三角锥结构中Si原子是1个,O原子个数=2+2×$\frac{1}{2}$=3,所以硅原子和氧原子个数之比=1:3,3个O原子带6个单位负电荷,每个硅原子带4个单位正电荷,所以形成离子为[SiO3]n2n- (或SiO32-),故答案为:1:3;SiO32-(或(SiO3)n2n-.
点评 本题考查物质结构和性质,为高频考点,涉及配合物的成键情况、共价键、微粒空间构型判断、晶体类型判断等知识点,会利用价层电子对互斥理论判断原子杂化及微粒空间构型、会利用均摊法确定化学式等,难点是(5)题,题目难度中等.

| A. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | Fe3+溶液中滴加过量的氨水:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H20 | |
| D. | NaHCO3的水解:HCO3-+H2O=CO32-+H3O+ |
 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】
①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 280 | 6.50×10-3 | 4.00×10-3 | 120 |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.50×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).

| A. | X、Y、Z元素分别为N、P、O | |
| B. | 白格中都是主族元素,灰格中都是副族元素 | |
| C. | 原子半径:Z>X>Y | |
| D. | X、Y、Z的气态氢化物中最稳定的是:X的氢化物 |
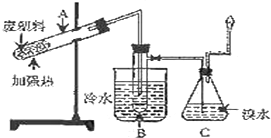 某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.
某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.该研究小组在实验中测得加热聚丙烯废塑料所得的产物如下表:
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$乙炔$\stackrel{③}{→}$聚乙炔该转化流程中,第②步反应的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑.
(2)试管B中收集到油状液体,其中的一种成分D能使酸性高锰酸钾溶液褪色.D与氯气在光照条件下生成一氯取代物的化学方程式为
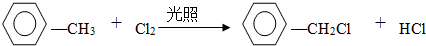 .
.(3)锥形瓶C中的现象是有气泡,溶液颜色渐渐褪去,气体经过锥形瓶C中的溴水充分吸收后再经干燥,所得气体的平均相对分子质量为4.8.
(4)C中逸出的气体在工业上可用作(至少两点)可做燃料、做化工生产原料.
| A. | 酒精和碘 | B. | 苯和水 | C. | 乙酸和乙酸乙酯 | D. | 乙酸和水 |
 请按要求回答下列问题:
请按要求回答下列问题: +2nH2O.
+2nH2O.