��Ŀ����
10�����ӱ����õ�ij��Ŧ�۵�صĵ缫����ΪZn��Ag2O���������Һ��KOH��Һ������ܷ�ӦʽΪ��Zn+Ag2O�TZnO+2Ag������˵��������ǣ�������| A�� | �õ�ص�������Ag2O��������Zn | |
| B�� | �õ�ظ����ĵ缫��ӦʽΪ��Zn+2OH--2e-�TZnO+H2O | |
| C�� | �����ϸõ�ع���һ��ʱ�����Һ��KOH��Ũ�Ȳ��� | |
| D�� | �õ�ع���ʱ��������е��������������ƶ� |
���� ���ݵ�ط�Ӧʽ֪��Znʧ������������Ag2O��������������ӦʽΪZn+2OH--2e-�TZnO+H2O��������ӦʽΪAg2O+H2O+2e-�T2Ag+2OH-���ŵ�ʱ���������Һ�����������ƶ����������������ƶ����ݴ˷������
��� �⣺A���÷�Ӧ��ZnԪ�ػ��ϼ���0�۱�Ϊ+2�ۡ�AgԪ�ػ��ϼ���+1�۱�Ϊ0�ۣ�����Znʧ������������Ag2O����������A��ȷ��
B��������Znʧ���ӷ���������Ӧ���缫��ӦʽΪZn+2OH--2e-�TZnO+H2O����B��ȷ��
C�����ݵ�ط�Ӧʽ֪��KOH���μӷ�Ӧ��Ҳû���������ʻ��ܼ����ɣ����������ϸõ�ع���һ��ʱ�����Һ��KOH��Ũ�Ȳ��䣬��C��ȷ��
D���ŵ�ʱ���������Һ�����������ƶ����������������ƶ�����D����
��ѡD��
���� ���⿼�黯ѧ��Դ���͵�أ�Ϊ��Ƶ���㣬��ȷ�ж��������ǽⱾ��ؼ����ѵ��ǵ缫��Ӧʽ����д���״�ѡ����D��֪�����������ƶ�������Ŀ�ѶȲ���

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
20�������ݻ��̶����ܱ��������з�ӦX��g��+2Y��g���T2Z��g������H=akJ/mol��a��0���������ܱ�������ͨ��1molX��2molY����ƽ��״̬ʱ����������bkJ���������ж���ȷ���ǣ�������
| A�� | ��a=b��0ʱ���÷�Ӧ�ﵽ��ѧƽ��״̬ | |
| B�� | �÷�Ӧ�ﵽ��ѧƽ��״̬ʱ��һ����a=b | |
| C�� | ���ܱ������������ܶȲ��ٸı�ʱ���÷�Ӧ�ﵽ��ѧƽ��״̬ | |
| D�� | �÷�Ӧ�ﵽ��ѧƽ��״̬ʱ���ܱ���������������ʵ���һ������ |
1������ȷ��ʾ���з�Ӧ�����ӷ���ʽΪ��������
| A�� | ��NH4HCO3��Һ�мӹ���NaOH��Һ�����ȣ�NH4++OH-$\frac{\underline{\;\;��\;\;}}{\;}$NH3��+H2O | |
| B�� | Fe3+��Һ�еμӹ����İ�ˮ��Fe3++3OH-=Fe��OH��3�� | |
| C�� | ����������ʵ���Ũ�ȵ�NaHCO3��Ba��OH��2��Һ��ϣ�HCO3-+Ba2++OH-�TBaCO3��+H20 | |
| D�� | NaHCO3��ˮ�⣺HCO3-+H2O=CO32-+H3O+ |
18��Ӱ�컯ѧ��Ӧ���ʵ����غܶ࣬ij������ȤС����ʵ��ķ�������̽����
��1��ʵ��һ��ȡ�����ʵ���Ũ�ȵ����H2O2��Һ�ֱ��������ʵ�飬ʵ�鱨�����±���ʾ��
�Իش𣺢�ʵ��1��2�о������¶ȶ�H2O2�ֽ����ʵ�Ӱ�죮
��ʵ��2��3��Ŀ���DZȽ�FeCl3��Һ��MnO2��Ϊ������˫��ˮ�ֽⷴӦ����Ӱ��IJ���
��2��ʵ��������о�֪Cu2+��H2O2�ֽ�Ҳ���д����ã�Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч������С���ͬѧ�ֱ��������ͼ�ס�����ʾ��ʵ�飮�ش�������⣺
�ٶ��Է�������ͼ��ͨ���۲췴Ӧ�������ݵĿ��������ԱȽϵó����ۣ���ͬѧ�����FeCl3��ΪFe2��SO4��3��Ϊ���������������ų������ӵĸ��ţ�
�ڶ���������Ϊ�˸���ȷ���о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬������ͼװ�ý��ж���ʵ�飮��ɸ�ʵ��Ӧ�òⶨ��ʵ�������Dzⶨһ��ʱ���ڲ��������壨��ⶨ����һ����������������ʱ�䣩��

ʵ��������֪2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2�����ڿ�ʼһ��ʱ���ڣ���Ӧ���ʽ�������Һ��ɫ�����ԣ�������ͻȻ��ɫ����Ӧ�������Լӿ죮
�������������ijͬѧ��Ϊ�÷�Ӧ���ȣ�������Һ�¶���������Ӧ���ʼӿ죮��Ӱ�컯ѧ��Ӧ���ʵ����ؿ�������뻹�����Ǵ������������̻�Mn2+�Ĵ����ã���Ӱ�죮��
������ʵ��֤����IJ��룬�����Ը��������Һ��������Һ�Լ��⣬����Ҫѡ����Լ��Ǻ�������B
A������ء�����B�������̡�������C��ˮ����������D���Ȼ��̣�
��1��ʵ��һ��ȡ�����ʵ���Ũ�ȵ����H2O2��Һ�ֱ��������ʵ�飬ʵ�鱨�����±���ʾ��
| ��� | ���� | ���� | ���� | |
| �¶�/�� | ���� | |||
| 1 | 40 | FeCl3��Һ | ||
| 2 | 20 | FeCl3��Һ | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | �� | ||
��ʵ��2��3��Ŀ���DZȽ�FeCl3��Һ��MnO2��Ϊ������˫��ˮ�ֽⷴӦ����Ӱ��IJ���
��2��ʵ��������о�֪Cu2+��H2O2�ֽ�Ҳ���д����ã�Ϊ�Ƚ�Fe3+��Cu2+��H2O2�ֽ�Ĵ�Ч������С���ͬѧ�ֱ��������ͼ�ס�����ʾ��ʵ�飮�ش�������⣺
�ٶ��Է�������ͼ��ͨ���۲췴Ӧ�������ݵĿ��������ԱȽϵó����ۣ���ͬѧ�����FeCl3��ΪFe2��SO4��3��Ϊ���������������ų������ӵĸ��ţ�
�ڶ���������Ϊ�˸���ȷ���о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬������ͼװ�ý��ж���ʵ�飮��ɸ�ʵ��Ӧ�òⶨ��ʵ�������Dzⶨһ��ʱ���ڲ��������壨��ⶨ����һ����������������ʱ�䣩��

ʵ��������֪2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2�����ڿ�ʼһ��ʱ���ڣ���Ӧ���ʽ�������Һ��ɫ�����ԣ�������ͻȻ��ɫ����Ӧ�������Լӿ죮
�������������ijͬѧ��Ϊ�÷�Ӧ���ȣ�������Һ�¶���������Ӧ���ʼӿ죮��Ӱ�컯ѧ��Ӧ���ʵ����ؿ�������뻹�����Ǵ������������̻�Mn2+�Ĵ����ã���Ӱ�죮��
������ʵ��֤����IJ��룬�����Ը��������Һ��������Һ�Լ��⣬����Ҫѡ����Լ��Ǻ�������B
A������ء�����B�������̡�������C��ˮ����������D���Ȼ��̣�
5����ijʵ��С���H2O2�ķֽ���������̽�����±��Ǹ�ʵ��С���о�Ӱ��H2O2�ֽ����ʵ�����ʱ��¼��һ�����ݣ���������ͬ��״̬��ͬ��MnO2�ֱ����ʢ��15ml 5%��H2O2��Һ�Ĵ��Թ��У����ô����ǵ�ľ�����ԣ�������£�
��1��д������ʵ���з�����Ӧ�Ļ�ѧ����ʽ��2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2����
��2��ʵ���������������Ĵ�Ч��������Ŀ�����С�йأ�
��3��ijͬѧ��10mL H2O2 ��Һ�м���һ�����Ķ������̣��ų�������������״�����뷴Ӧʱ��Ĺ�ϵ��ͼ1��ʾ����A��B��C��������ʾ�ļ�ʱ��Ӧ������������C��
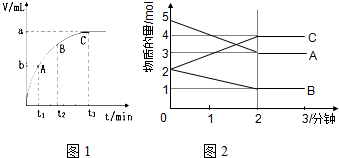
��ij��Ӧ�����Ϊ5L�ĺ����ܱ������н��У���0-3�����ڸ����ʵ����ı仯�����ͼ2��ʾ��A��B��C��Ϊ���壬��A��������ɫ����
��4���÷�Ӧ�Ļ�ѧ����ʽΪ2A+B?2C��
��5����Ӧ��ʼ��2����ʱ��B��ƽ����Ӧ����Ϊ0.1mol/��L•min����
��6����˵���÷�Ӧ�Ѵﵽƽ��״̬����cd
a��v��A��=2v��B�� b�������ڸ����ʵ����ʵ������
c��v����A��=v����C�� d���������������ɫ���ֲ���
��7����ͼ���ƽ��ʱA��ת����Ϊ40%��
| MnO2 | �����Թ���� | �۲��� | ��Ӧ��������ʱ�� |
| ��ĩ״ | ���� | ���ҷ�Ӧ�������ǵ�ľ����ȼ | 3.5 min |
| ��״ | �� | ��Ӧ���������Ǻ�����ľ��δ��ȼ | 30min |
��2��ʵ���������������Ĵ�Ч��������Ŀ�����С�йأ�
��3��ijͬѧ��10mL H2O2 ��Һ�м���һ�����Ķ������̣��ų�������������״�����뷴Ӧʱ��Ĺ�ϵ��ͼ1��ʾ����A��B��C��������ʾ�ļ�ʱ��Ӧ������������C��

��ij��Ӧ�����Ϊ5L�ĺ����ܱ������н��У���0-3�����ڸ����ʵ����ı仯�����ͼ2��ʾ��A��B��C��Ϊ���壬��A��������ɫ����
��4���÷�Ӧ�Ļ�ѧ����ʽΪ2A+B?2C��
��5����Ӧ��ʼ��2����ʱ��B��ƽ����Ӧ����Ϊ0.1mol/��L•min����
��6����˵���÷�Ӧ�Ѵﵽƽ��״̬����cd
a��v��A��=2v��B�� b�������ڸ����ʵ����ʵ������
c��v����A��=v����C�� d���������������ɫ���ֲ���
��7����ͼ���ƽ��ʱA��ת����Ϊ40%��
2�� Ŀǰ���������̳����ô�������β���е�NO��COת����CO2��N2����ѧ����ʽ���£�2NO+2CO$\stackrel{����}{?}$2CO2+N2��Ϊ�о������߸�ת�����̷�Ӧ���ʣ�ij���������������ʵ��̽����
Ŀǰ���������̳����ô�������β���е�NO��COת����CO2��N2����ѧ����ʽ���£�2NO+2CO$\stackrel{����}{?}$2CO2+N2��Ϊ�о������߸�ת�����̷�Ӧ���ʣ�ij���������������ʵ��̽����
�����ϲ��ġ�
�ٲ�ͬ�Ĵ�����ͬһ��Ӧ�Ĵ�Ч�ʲ�ͬ��
��ʹ����ͬ�Ĵ������������������ʱ�������ıȱ�����Դ�Ч����Ӱ�죮
��ʵ����ơ�������Ϊ̽��ijЩ�������������β��ת����Ӧ���ʵ�Ӱ����ɣ���������¶Ա�ʵ�飮
��1���������ʵ����Ʊ������в�Ҫ���ո�
��ͼ���������ۡ��������崫�����ⶨ������ʵ����COŨ����ʱ��仯������ͼ�����£�
��2������ڢ���ʵ���У���ƽ��ʱNO��Ũ��Ϊ3.50��10-3mol/L��
��3�������ߢ��֪����������ȱ����������β��ת�������������������С��������Ӱ�족����
 Ŀǰ���������̳����ô�������β���е�NO��COת����CO2��N2����ѧ����ʽ���£�2NO+2CO$\stackrel{����}{?}$2CO2+N2��Ϊ�о������߸�ת�����̷�Ӧ���ʣ�ij���������������ʵ��̽����
Ŀǰ���������̳����ô�������β���е�NO��COת����CO2��N2����ѧ����ʽ���£�2NO+2CO$\stackrel{����}{?}$2CO2+N2��Ϊ�о������߸�ת�����̷�Ӧ���ʣ�ij���������������ʵ��̽���������ϲ��ġ�
�ٲ�ͬ�Ĵ�����ͬһ��Ӧ�Ĵ�Ч�ʲ�ͬ��
��ʹ����ͬ�Ĵ������������������ʱ�������ıȱ�����Դ�Ч����Ӱ�죮
��ʵ����ơ�������Ϊ̽��ijЩ�������������β��ת����Ӧ���ʵ�Ӱ����ɣ���������¶Ա�ʵ�飮
��1���������ʵ����Ʊ������в�Ҫ���ո�
| ʵ���� | ʵ��Ŀ�� | T/�� | NO��ʼŨ�� mol/L | CO��ʼŨ�� mol/L | ͬ�ִ����ıȱ����m2/g |
| �� | Ϊ����ʵ�������� | 280 | 6.50��10-3 | 4.00��10-3 | 80 |
| �� | ̽�������ȱ������β��ת�����ʵ�Ӱ�� | 280 | 6.50��10-3 | 4.00��10-3 | 120 |
| �� | ̽���¶ȶ�β��ת�����ʵ�Ӱ�� | 360 | 6.50��10-3 | 4.00��10-3 | 80 |
��2������ڢ���ʵ���У���ƽ��ʱNO��Ũ��Ϊ3.50��10-3mol/L��
��3�������ߢ��֪����������ȱ����������β��ת�������������������С��������Ӱ�족����

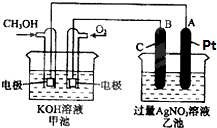 �밴Ҫ��ش��������⣺
�밴Ҫ��ش��������⣺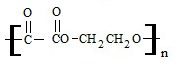 +2nH2O��
+2nH2O��