题目内容
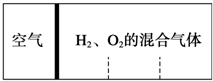 如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的
如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的| 1 |
| 4 |
| A、2:7 | B、5:4 |
| C、2:1 | D、4:5 |
考点:物质的量的相关计算
专题:计算题
分析:反应前,左右两室的体积之比为1:3,则左右两室中气体物质的量之比为1:3,反应后,活塞处于中央,两室体积相等,则两室中气体的物质的量相等,令空气的物质的量为1mol,设H2、O2的物质的量分别为xmol、ymol,讨论氢气或氧气过量计算解答.
解答:
解:令空气的物质的量为1mol,反应前,左右两室的体积之比为1:3,反应前右室的物质的量为3mol,反应后,活塞处于中央,两室体积相等,则两室中气体的物质的量相等,反应后右室气体物质的量为1mol,发生反应2H2+O2
2H2O,
设H2、O2的物质的量分别为xmol、ymol,
若氢气过量,则:
,解得x:y=7:2,
若氧气过量,则:
,解得x:y=4:5,
故选D.
| ||
设H2、O2的物质的量分别为xmol、ymol,
若氢气过量,则:
|
若氧气过量,则:
|
故选D.
点评:本题考查混合物计算,注意左室中气体物质的量不变,据此根据体积变化判断右室反应前后气体物质的量,再利用赋值法与讨论法计算,难度中等.

练习册系列答案
相关题目
完全燃烧2mol某有机物,生成4mol CO2和6mol H2O,同时消耗5mol O2,该有机物的分子式为( )
| A、C2H6O2 |
| B、C2H4O |
| C、C2H6O |
| D、C2H6 |
在高中我们将从元素原子得失电子的角度来认识氧化还原反应,而元素原子得失电子表现为元素化合价的变化.因此可以把元素化合价有升降的化学反应确定为氧化还原反应,据此可判断下列化学反应不属于氧化还原反应的是( )
| A、Zn+CuSO4=ZnSO4+Cu | ||||
B、CuO+CO
| ||||
| C、Na2CO3+2HCl=2NaCl+H2O+CO2↑ | ||||
D、2KClO3
|
不能由单质直接化合得到的物质是( )
| A、Cu2S |
| B、FeCl2 |
| C、FeS |
| D、Al2S3 |
下列离子方程式正确的是( )
| A、碳酸钡与盐酸反应:2H++BaCO3=Ba2++H2O+CO2↑ |
| B、氢氧化钡溶液与稀硫酸混合:Ba2++SO42-+H++OH-=BaSO4↓+H2O |
| C、氯气通入蒸馏水中:Cl2+H2O=Cl-+ClO-+2H+ |
| D、CO2通入过量的澄清石灰水中:CO2+Ca(OH)2=CaCO3↓+H2O |
下列物质中能与NaOH溶液反应的是( )
| A、Mg | B、Fe | C、Al | D、Cu |
下列推断正确的是( )
| A、SiO2能与NaOH溶液、HF溶液反应,所以SiO2是两性氧化物 |
| B、新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
| C、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D、Na2O、Na2O2组成元素相同,阳离子与阴离子个数比也相同 |
下列反应的离子方程式书写正确的是( )
| A、氧化钠与水反应:O2-+H2O=2OH- |
| B、NO2与水反应:3NO2+H2O=2H++2NO3-+NO |
| C、用食醋除水垢中的反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3- |
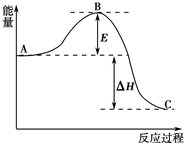 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.