题目内容
完全燃烧2mol某有机物,生成4mol CO2和6mol H2O,同时消耗5mol O2,该有机物的分子式为( )
| A、C2H6O2 |
| B、C2H4O |
| C、C2H6O |
| D、C2H6 |
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:根据C、H原子守恒确定有机物分子中C、H原子数目,再结合耗氧量确定有机物分子中O原子数目.
解答:
解:完全燃烧2mol某有机物,生成4mol CO2和6mol H2O,同时消耗5mol O2,
则有机物分子中C原子数目=
=2、H原子数目=
=6,
设有机物分子式为C2H6On,根据耗氧量,则:2mol×(2+
-
)=5,解得n=2,
故该有机物的分子式为C2H6O2,
故选A.
则有机物分子中C原子数目=
| 4mol |
| 2mol |
| 6mol×2 |
| 2mol |
设有机物分子式为C2H6On,根据耗氧量,则:2mol×(2+
| 6 |
| 4 |
| n |
| 2 |
故该有机物的分子式为C2H6O2,
故选A.
点评:本题考查有机物分子式确定,难度不大,注意利用通式理解烃及含氧衍生物的耗氧量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、电解质与非电解质的本质区别是在水溶液或熔化状态下能否电离 |
| B、盐酸的导电性一定比醋酸的强 |
| C、酸、碱和盐类都属于电解质,其他化合物都是非电解质 |
| D、溶于水能导电的化合物一定是电解质 |
下列说法正确的是( )
| A、水泥、玻璃、陶瓷、水晶都属于硅酸盐产品 |
| B、二氧化碳通入水玻璃可以得到硅酸 |
| C、因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以酸性硅酸比碳酸强 |
| D、可以用澄清石灰水鉴别SO2和CO2 |
对以下化学问题的解释中错误的是( )
| A、工业盐酸显黄色,是由于含有杂质FeCl3 |
| B、碘化钾溶液久置显黄色,是由于I被氧化,析出的I2溶于溶液中 |
| C、浓硝酸显黄色,是由于硝酸见光分解生成的NO2溶液酸液中 |
| D、炼钢是在高温下利用还原剂除去生铁中的杂质 |
对实验A-D的实验现象预测正确的是( )
A、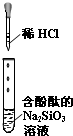 试管中红色溶液逐渐变成无色溶液 |
B、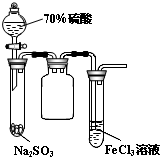 试管中出现淡黄色浑浊 |
C、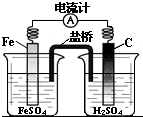 铁棒上有无色气泡产生 |
D、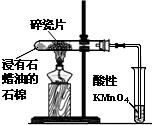 酸性KMnO4溶液中出现气泡且颜色逐渐褪去 |
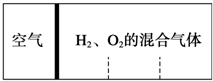 如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的
如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的| 1 |
| 4 |
| A、2:7 | B、5:4 |
| C、2:1 | D、4:5 |
下列实验操作中正确的是( )
| A、蒸发操作时,应将蒸发皿放在石棉网上进行加热 |
| B、焰色反应实验中可用铜丝代替铂丝完成实验 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、向1mol?L-1氯化铁溶液中加入少量的NaOH溶液制取氢氧化铁胶体 |