题目内容
6.在体积为1L的密闭容器中,进行如下可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),化学平衡常数(K)与温度(T)的关系如下表:| t(℃) | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该可逆反应化学平衡常数的表达式K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)升高温度,化学平衡向正反应方向(填“正反应方向”或“逆反应方向”)移动.
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中的压强不变
B.H2的质量分数保持不变
C.两个C=O键断裂的同时有两个H-O键断裂
D.K不变
E.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下列关系:c(CO2)•c(H2)=c(CO)•c(H2O),此时的温度为850℃;在此温度下,若该容器中含有1mol CO2、1.2mol H2、0.75mol CO、1.5molH2O(g),则此时反应所处的状态为向正反应方向进行中(填“向正反应方向进行中”、“向逆反应方向进行中”或“平衡状态”).
(5)在850℃下,将1.5mol CO2、1.0mol H2混合于该1L的密闭容器中,在该温度下达到平衡时,H2的转化率为60%.
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(2)由表中数据可知,升高温度平衡常数增大,说明升高温度平衡正向移动;
(3)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(4)某温度下,平衡浓度符合:c(CO2)•c(H2)=c(CO)•c(H2O),说明平衡常数K=1;
计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
(5)设氢气转化率为x,则转化的氢气为xmol,表示出平衡时各组分物质的量,再利用平衡常数列方程计算解答.
解答 解:(1)CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数k=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,
故答案为:$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$;
(2)由表中数据可知,温度越高平衡常数越大,说明升高温度平衡向正反应方向移动
故答案为:正反应方向;
(3)A.反应前后气体的物质的量不变,容器内压强自始至终不变,容器中压强变,不能说明反应到达平衡,故A错误;
B.到达平衡时各组分含量不变,H2的质量分数保持不变,说明反应到达平衡,故B正确;
C.两个C=O键断裂的同时有两个H-O键断裂,两个H-O键断裂时会生成2个C=O,说明二氧化碳的生成速率与消耗速率相等,说明反应到达平衡,故C正确;
D.温度不变,平衡常数不变,故D错误;
E.c(CO2)=c(CO)时可能处于平衡状态,可能不处于平衡状态,与反应的条件有关,即与二氧化碳的转化率有关,故E错误;
故选:BC;
(4)根据c(CO2)•c(H2)=c(CO)•c(H2O)可知,该温度下的平衡常数$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$=1,平衡常数只与温度有关,故此时温度为850℃,
此时浓度商Qc=$\frac{0.75×1.5}{1×1.2}$=0.94<850℃时平衡常数K=1,反应向正反应方向进行,
故答案为:850℃;向正反应方向进行中;
(5)设氢气转化率为x,转化的氢气为xmol,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
起始量(mol):1.5 1 0 0
变化量(mol):x x x x
平衡量(mol):1.5-x 1-x x x
则$\frac{x×x}{(1.5-x)×(1-x)}$=1,解得x=60%,
故答案为:60%.
点评 本题考查化学平衡常数的应用、化学平衡状态的判断,难度中等,掌握化学平衡常数的书写与应用,注意判断化学平衡状态,选择的物理量应是随反应进行发生不变,当该物理量不再变化时,说明到达平衡状态.

| A. | 化学家可以制造出自然界中不存在的物质 | |
| B. | 化学的特征就是认识分子和制造分子,是一门具有创造性和实用性的科学 | |
| C. | 利用化学变化可以制造出新的分子,但不能制造出新的原子 | |
| D. | 化学研究会造成严重的环境污染,最终人类将会毁灭在化学物质中 |
| A. | 完全反应后所得溶液具有漂白性 | B. | 只发生了氧化还原反应 | ||
| C. | 会产生有刺激性气味的气体SO2 | D. | 溶液中存在HSO3- |
| A. | C→CO2 | B. | CO→CO2 | C. | CuO→Cu | D. | H2SO4→BaSO4 |
 A、B、C、D、E、F为原子序数依次增大的短周期元素,G为第四周期元素,B、C相邻且同周期,A、D同主族.A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂.E是地壳中含量最多的金属元素.F元素为同周期电负性最大的元素.D和F可形成化合物丙,E和F可形成化合物丁.G为第四周期未成对电子数最多的元素.请回答下列问题:
A、B、C、D、E、F为原子序数依次增大的短周期元素,G为第四周期元素,B、C相邻且同周期,A、D同主族.A、C能形成两种化合物甲和乙,原子个数比分别为2:1和1:1,甲为常见的溶剂.E是地壳中含量最多的金属元素.F元素为同周期电负性最大的元素.D和F可形成化合物丙,E和F可形成化合物丁.G为第四周期未成对电子数最多的元素.请回答下列问题: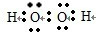 ,其分子内存在极性、非极性键.
,其分子内存在极性、非极性键.