题目内容
15.过氧化氢(H2O2)的水溶液俗称双氧水,近年来倍受人们的青睐,被称为“绿色氧化剂”.(1)写出H2O2的电子式
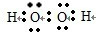 ,其分子内存在极性、非极性键.
,其分子内存在极性、非极性键.(2)与H2O2分子具有相同电子数的双原子单质分子为(写化学式)F2,与H2O2分子具有相同电子数的三原子化合物分子为(写化学式)H2S.
(3)某工业废水中含有一定量氯气,为了除去氯气,常加入H2O2作脱氯剂,写出该反应的化学方程式为Cl2+H2O2=2HCl+O2↑.
分析 (1)根据电子式的书写方法来写电子式并利用原子序数来分析电子排布;不同非金属元素之间形成极性共价键,同种非金属元素之间形成非极性共价键;
(2)过氧化氢分子中含有18个电子,含有18个电子的单质为氟气,含有3原子的化合物为硫化氢;
(3)氯气具有强氧化性,能把双氧水氧化生成氧气和水.
解答 解:(1)双氧水是一种含有氧氧共价键和氧氢共价键的极性分子,电子式为: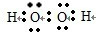 ;氢与氧形成极性键,氧与氧形成非极性键,
;氢与氧形成极性键,氧与氧形成非极性键,
故答案为: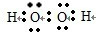 ;极性、非极性;
;极性、非极性;
(2)双氧水中含有18个电子,所以与H2O2分子具有相同电子数的双原子单质分子为F2,而与H2O2分子具有相同电子数的三原子化合物分子为H2S,
故答案为:F2;H2S;
(3)氯气具有强氧化性,能把双氧水氧化生成氧气和水,反应的方程式是:Cl2+H2O2=2HCl+O2↑,
故答案为:Cl2+H2O2=2HCl+O2↑.
点评 本题考查了过氧化氢的组成、结构与性质,题目难度不大,明确过氧化氢的结构与性质为解答关键,注意掌握电子式的书写原则、共价键类型及判断方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
17.下列关于物质分类的说法正确的是( )
| A. | 根据原子最外层电子数的多少可将元素分为金属元素和非金属元素 | |
| B. | 根据酸分子中含有的氢原子个数可将酸分为一元酸、二元酸、三元酸等 | |
| C. | 汽油、漂白粉、水玻璃、王水均为混合物 | |
| D. | 纯碱、熟石灰、醋酸、食盐水均为电解质 |
6.在体积为1L的密闭容器中,进行如下可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),化学平衡常数(K)与温度(T)的关系如下表:
请回答下列问题:
(1)该可逆反应化学平衡常数的表达式K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)升高温度,化学平衡向正反应方向(填“正反应方向”或“逆反应方向”)移动.
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中的压强不变
B.H2的质量分数保持不变
C.两个C=O键断裂的同时有两个H-O键断裂
D.K不变
E.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下列关系:c(CO2)•c(H2)=c(CO)•c(H2O),此时的温度为850℃;在此温度下,若该容器中含有1mol CO2、1.2mol H2、0.75mol CO、1.5molH2O(g),则此时反应所处的状态为向正反应方向进行中(填“向正反应方向进行中”、“向逆反应方向进行中”或“平衡状态”).
(5)在850℃下,将1.5mol CO2、1.0mol H2混合于该1L的密闭容器中,在该温度下达到平衡时,H2的转化率为60%.
| t(℃) | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该可逆反应化学平衡常数的表达式K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)升高温度,化学平衡向正反应方向(填“正反应方向”或“逆反应方向”)移动.
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中的压强不变
B.H2的质量分数保持不变
C.两个C=O键断裂的同时有两个H-O键断裂
D.K不变
E.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下列关系:c(CO2)•c(H2)=c(CO)•c(H2O),此时的温度为850℃;在此温度下,若该容器中含有1mol CO2、1.2mol H2、0.75mol CO、1.5molH2O(g),则此时反应所处的状态为向正反应方向进行中(填“向正反应方向进行中”、“向逆反应方向进行中”或“平衡状态”).
(5)在850℃下,将1.5mol CO2、1.0mol H2混合于该1L的密闭容器中,在该温度下达到平衡时,H2的转化率为60%.
3. A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:
A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:
(1)A、B、C元素的第一电离能由大到小的顺序为N>O>C(用元素符号表示).F的基态原子核外电子排布式为1s22s22p63s23p63d104s1.
(2)AE2是一种常用的溶剂,是非极性(填“极性”或“非极性”)分子,分子中σ键与π键个数比为1:1.
(3)写出D与NaOH溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.DB形成的晶体与金刚石类似,它属
于原子晶体.B的最简单氢化物容易液化,理由是NH3分子之间存在氢键
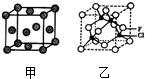
(4)已知F的晶体结构如图甲所示,又知F的密度为9.00g•cm-3,则晶胞边长为$\root{3}{\frac{256}{9{N}_{A}}}$cm;FEC4常作电镀液,其中EC${\;}_{4}^{2-}$的空间构型是正四面体,其中E原子的杂化轨道类型是sp3.
(5)F的一种氯化物晶胞体结构如图乙所示,该氯化物的化学式是CuCl.
 A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:
A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:| 元素 | 相关信息 |
| A | 可形成自然界硬度最大的单质 |
| B | 与A元素同周期,核外有三个未成对电子 |
| C | 最外层电子数是其电子层数的3倍 |
| D | 第一电离能至第四电离能分别是I1=578KJ/mol,I2=1817KJ/mol,I3=2745KJ/mol, I4=11575KJ/mol |
| E | 常温常压下,E的单质是固体,其氧化物是形成酸雨的主要物质 |
| F | F的一种同位素的质量数为63,中子数为34 |
(2)AE2是一种常用的溶剂,是非极性(填“极性”或“非极性”)分子,分子中σ键与π键个数比为1:1.
(3)写出D与NaOH溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.DB形成的晶体与金刚石类似,它属
于原子晶体.B的最简单氢化物容易液化,理由是NH3分子之间存在氢键
(4)已知F的晶体结构如图甲所示,又知F的密度为9.00g•cm-3,则晶胞边长为$\root{3}{\frac{256}{9{N}_{A}}}$cm;FEC4常作电镀液,其中EC${\;}_{4}^{2-}$的空间构型是正四面体,其中E原子的杂化轨道类型是sp3.
(5)F的一种氯化物晶胞体结构如图乙所示,该氯化物的化学式是CuCl.
20.将agFe和Cu的混合粉末加入到100mL4mol/L的稀硝酸中充分反应后(假设还原产物只有NO),下列说法正确的是( )
| A. | 若反应后有Cu剩余,则反应后溶液中含有的金属阳离子一定是Cu2+ | |
| B. | 若反应后的溶液中有Cu2+,则反应后溶液中含有的金属阳离子一定是Fe2+、Fe3+ | |
| C. | 若加入的Fe和Cu的质量比为7:8,则使HNO3完全反应的金属粉末质量最小为7.2g | |
| D. | 若两者恰好反应,则加入金属粉末质量8.4g<a<9.6g |
4.完全燃烧96g炭放出热量3134.4kJ,以下热化学方程式正确的是( )
| A. | C(s)+O2(g)=CO2(g)△H=+391.8kJ/mol | B. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-391.8kJ/mol | ||
| C. | C(s)+O2(g)=CO2(g)△H=-391.8kJ/mol | D. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=+391.8kJ/mol |
5.过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒)、细菌、真菌及芽孢.有关过氧乙酸的叙述正确的是( )
| A. | 过氧乙酸不能使品红褪色 | |
| B. | 过氧乙酸可与苯酚混合使用 | |
| C. | 过氧乙酸分子中只含有极性键 | |
| D. | 过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体 |
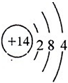 ,写出D2A2、C2A电子式,D2A2:
,写出D2A2、C2A电子式,D2A2: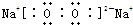 ,C2A:
,C2A: .
.