题目内容
11.2molCO的质量是56g;在标准状况下所占的体积约为44.8L;所含分子数目约为1.204×1024;将质量比为14:22的CO和CO2混合,则混合气体中CO和CO2的物质的量之比为1:1.分析 根据m=nM计算CO质量,根据V=nVm计算其体积,根据N=nNA计算CO分子数目;根据n=$\frac{m}{M}$计算CO和CO2的物质的量之比.
解答 解:2molCO的质量是2mol×28g/mol=56g,在标准状况下所占的体积约为2mol×22.4L/mol=44.8L 所含分子数目约为2mol×6.02×1023mol-1=1.204×1024;
根据n=$\frac{m}{M}$可知,质量比为14:22的CO和CO2的物质的量之比为$\frac{14g}{28g/mol}$:$\frac{22g}{44g/mol}$=1:1,
故答案为:56g;44.8L;1.204×1024;1:1.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的计算,有利于基础知识的巩固.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
14.根据2KMnO4+5H2O2+3H2SO4→2MnSO4+K2SO4+8H2O+5O2↑,可以判断( )
| A. | 氧化性:H2O2>KMnO4 | B. | 还原性:KMnO4>O2 | ||
| C. | 氧化性:KMnO4>O2 | D. | 还原性:H2SO4>K2SO4 |
6.在体积为1L的密闭容器中,进行如下可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),化学平衡常数(K)与温度(T)的关系如下表:
请回答下列问题:
(1)该可逆反应化学平衡常数的表达式K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)升高温度,化学平衡向正反应方向(填“正反应方向”或“逆反应方向”)移动.
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中的压强不变
B.H2的质量分数保持不变
C.两个C=O键断裂的同时有两个H-O键断裂
D.K不变
E.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下列关系:c(CO2)•c(H2)=c(CO)•c(H2O),此时的温度为850℃;在此温度下,若该容器中含有1mol CO2、1.2mol H2、0.75mol CO、1.5molH2O(g),则此时反应所处的状态为向正反应方向进行中(填“向正反应方向进行中”、“向逆反应方向进行中”或“平衡状态”).
(5)在850℃下,将1.5mol CO2、1.0mol H2混合于该1L的密闭容器中,在该温度下达到平衡时,H2的转化率为60%.
| t(℃) | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该可逆反应化学平衡常数的表达式K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)升高温度,化学平衡向正反应方向(填“正反应方向”或“逆反应方向”)移动.
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中的压强不变
B.H2的质量分数保持不变
C.两个C=O键断裂的同时有两个H-O键断裂
D.K不变
E.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下列关系:c(CO2)•c(H2)=c(CO)•c(H2O),此时的温度为850℃;在此温度下,若该容器中含有1mol CO2、1.2mol H2、0.75mol CO、1.5molH2O(g),则此时反应所处的状态为向正反应方向进行中(填“向正反应方向进行中”、“向逆反应方向进行中”或“平衡状态”).
(5)在850℃下,将1.5mol CO2、1.0mol H2混合于该1L的密闭容器中,在该温度下达到平衡时,H2的转化率为60%.
16.将40克NaOH溶于水配成1L溶液,则该溶液的物质的量浓度为( )
| A. | 0.1mol/L | B. | 0.5mol/L | C. | 4mol/L | D. | 1mol/L |
3. A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:
A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:
(1)A、B、C元素的第一电离能由大到小的顺序为N>O>C(用元素符号表示).F的基态原子核外电子排布式为1s22s22p63s23p63d104s1.
(2)AE2是一种常用的溶剂,是非极性(填“极性”或“非极性”)分子,分子中σ键与π键个数比为1:1.
(3)写出D与NaOH溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.DB形成的晶体与金刚石类似,它属
于原子晶体.B的最简单氢化物容易液化,理由是NH3分子之间存在氢键
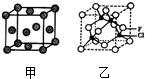
(4)已知F的晶体结构如图甲所示,又知F的密度为9.00g•cm-3,则晶胞边长为$\root{3}{\frac{256}{9{N}_{A}}}$cm;FEC4常作电镀液,其中EC${\;}_{4}^{2-}$的空间构型是正四面体,其中E原子的杂化轨道类型是sp3.
(5)F的一种氯化物晶胞体结构如图乙所示,该氯化物的化学式是CuCl.
 A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:
A、B、C、D、E、F是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:| 元素 | 相关信息 |
| A | 可形成自然界硬度最大的单质 |
| B | 与A元素同周期,核外有三个未成对电子 |
| C | 最外层电子数是其电子层数的3倍 |
| D | 第一电离能至第四电离能分别是I1=578KJ/mol,I2=1817KJ/mol,I3=2745KJ/mol, I4=11575KJ/mol |
| E | 常温常压下,E的单质是固体,其氧化物是形成酸雨的主要物质 |
| F | F的一种同位素的质量数为63,中子数为34 |
(2)AE2是一种常用的溶剂,是非极性(填“极性”或“非极性”)分子,分子中σ键与π键个数比为1:1.
(3)写出D与NaOH溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.DB形成的晶体与金刚石类似,它属
于原子晶体.B的最简单氢化物容易液化,理由是NH3分子之间存在氢键
(4)已知F的晶体结构如图甲所示,又知F的密度为9.00g•cm-3,则晶胞边长为$\root{3}{\frac{256}{9{N}_{A}}}$cm;FEC4常作电镀液,其中EC${\;}_{4}^{2-}$的空间构型是正四面体,其中E原子的杂化轨道类型是sp3.
(5)F的一种氯化物晶胞体结构如图乙所示,该氯化物的化学式是CuCl.
20.将agFe和Cu的混合粉末加入到100mL4mol/L的稀硝酸中充分反应后(假设还原产物只有NO),下列说法正确的是( )
| A. | 若反应后有Cu剩余,则反应后溶液中含有的金属阳离子一定是Cu2+ | |
| B. | 若反应后的溶液中有Cu2+,则反应后溶液中含有的金属阳离子一定是Fe2+、Fe3+ | |
| C. | 若加入的Fe和Cu的质量比为7:8,则使HNO3完全反应的金属粉末质量最小为7.2g | |
| D. | 若两者恰好反应,则加入金属粉末质量8.4g<a<9.6g |
1.2015年8月12日晚,天津塘沽滨海新区危险品仓库发生大爆炸,造成了巨大损失.据悉,该危险品仓库存放的危险品有多种,包括剧毒化学品氰化钠(NaCN).用过氧化氢处理氰化钠现场和水污染的方程式为NaCN+H2O2+H2O=NaHCO3+NH3↑,下列有关氰化钠的说法中错误的是( )
| A. | 用双氧水处理现场前应紧急疏散群众 | |
| B. | NaCN中碳元素的化合价为+4 | |
| C. | 每生成1molNH3转移2 mol 电子 | |
| D. | 为防止中毒,须加强对地表水、排海口等的氰化物排查 |
 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.