题目内容
9.向饱和氯水中加入过量的亚硫酸钠粉末,下列有关说法正确的是( )| A. | 完全反应后所得溶液具有漂白性 | B. | 只发生了氧化还原反应 | ||
| C. | 会产生有刺激性气味的气体SO2 | D. | 溶液中存在HSO3- |
分析 向饱和氯水中加入过量的亚硫酸钠粉末,发生的反应为Cl2+Na2SO3+H2O=2HCl+Na2SO4,2HCl+Na2SO3=2NaCl+NaHSO3,则溶液中的溶质为Na2SO4、Na2SO3、NaCl、NaHSO3,据此分析解答.
解答 解:向饱和氯水中加入过量的亚硫酸钠粉末,发生的反应为Cl2+Na2SO3+H2O=2HCl+Na2SO4,2HCl+Na2SO3=2NaCl+NaHSO3,则溶液中的溶质为Na2SO4、Na2SO3、NaCl、NaHSO3,
A.溶液中的溶质为Na2SO4、Na2SO3、NaCl、NaHSO3,这些物质都没有漂白性,故A错误;
B.根据以上分析知,发生了氧化还原反应、复分解反应,故B错误;
C.根据以上分析知,没有二氧化硫生成,故C错误;
D.溶液中存在溶质NaHSO3,且亚硫酸根离子水解液生成HSO3-,故D正确;
故选D.
点评 本题以氯气为载体考查氧化还原反应,为高频考点,明确物质之间发生的反应及溶液中溶质成分是解本题关键,题目难度不大.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
19.化学与人类生活密切相关,下列与化学有关的说法不正确的是( )
| A. | 化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的元凶 | |
| B. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 含氟牙膏可以有效防止龋齿 | |
| D. | 化学药品着火,都要立即用水或泡沫灭火器灭火 |
17.下列关于物质分类的说法正确的是( )
| A. | 根据原子最外层电子数的多少可将元素分为金属元素和非金属元素 | |
| B. | 根据酸分子中含有的氢原子个数可将酸分为一元酸、二元酸、三元酸等 | |
| C. | 汽油、漂白粉、水玻璃、王水均为混合物 | |
| D. | 纯碱、熟石灰、醋酸、食盐水均为电解质 |
14.根据2KMnO4+5H2O2+3H2SO4→2MnSO4+K2SO4+8H2O+5O2↑,可以判断( )
| A. | 氧化性:H2O2>KMnO4 | B. | 还原性:KMnO4>O2 | ||
| C. | 氧化性:KMnO4>O2 | D. | 还原性:H2SO4>K2SO4 |
1.配制下列溶液时常需加人少量括号内的物质.其中不是为了抑制离子水解的是( )
| A. | FeSO4(Fe) | B. | SnCl2(HCl) | C. | FeCl3(HCl) | D. | NaAlO2(NaOH) |
6.在体积为1L的密闭容器中,进行如下可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),化学平衡常数(K)与温度(T)的关系如下表:
请回答下列问题:
(1)该可逆反应化学平衡常数的表达式K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)升高温度,化学平衡向正反应方向(填“正反应方向”或“逆反应方向”)移动.
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中的压强不变
B.H2的质量分数保持不变
C.两个C=O键断裂的同时有两个H-O键断裂
D.K不变
E.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下列关系:c(CO2)•c(H2)=c(CO)•c(H2O),此时的温度为850℃;在此温度下,若该容器中含有1mol CO2、1.2mol H2、0.75mol CO、1.5molH2O(g),则此时反应所处的状态为向正反应方向进行中(填“向正反应方向进行中”、“向逆反应方向进行中”或“平衡状态”).
(5)在850℃下,将1.5mol CO2、1.0mol H2混合于该1L的密闭容器中,在该温度下达到平衡时,H2的转化率为60%.
| t(℃) | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该可逆反应化学平衡常数的表达式K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$.
(2)升高温度,化学平衡向正反应方向(填“正反应方向”或“逆反应方向”)移动.
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中的压强不变
B.H2的质量分数保持不变
C.两个C=O键断裂的同时有两个H-O键断裂
D.K不变
E.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下列关系:c(CO2)•c(H2)=c(CO)•c(H2O),此时的温度为850℃;在此温度下,若该容器中含有1mol CO2、1.2mol H2、0.75mol CO、1.5molH2O(g),则此时反应所处的状态为向正反应方向进行中(填“向正反应方向进行中”、“向逆反应方向进行中”或“平衡状态”).
(5)在850℃下,将1.5mol CO2、1.0mol H2混合于该1L的密闭容器中,在该温度下达到平衡时,H2的转化率为60%.
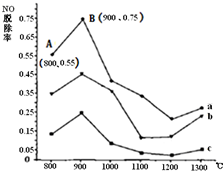 燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.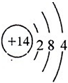 ,写出D2A2、C2A电子式,D2A2:
,写出D2A2、C2A电子式,D2A2: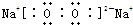 ,C2A:
,C2A: .
.