题目内容
15.下表是部分短周期元素的原子半径及主要化合价,根据表中信息判断正确的是( )| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 氢化物的沸点为H2T>H2R | |
| D. | 单质与浓度相等的稀盐酸反应的剧烈程度为Q>L |
分析 短周期元素,由元素的化合价可知,L和Q的化合价都为+2价,处于ⅡA族,L原子半径较大,故Q为Be,L为Mg;R和T都有-2价,应为ⅥA族元素,R的最高价为+6价,则T为O元素,R为S元素;M的化合价为+3价,应为ⅢA族元素,M原子半径介于Mg、S之间,则M为Al元素.
A.核外电子数=质子数-离子带的电荷.
B.氧化铝能与酸反应生成相应的盐与水,与碱反应生成相应的盐与水;
C.水分子之间存在氢键,沸点高于硫化氢;
D.金属性越强,与酸反应越剧烈.
解答 解:短周期元素,由元素的化合价可知,L和Q的化合价都为+2价,处于ⅡA族,L原子半径较大,故Q为Be,L为Mg;R和T都有-2价,应为ⅥA族元素,R的最高价为+6价,则T为O元素,R为S元素;M的化合价为+3价,应为ⅢA族元素,M原子半径介于Mg、S之间,则M为Al元素.
A.Mg2+核外有10个电子,S2-核外有18个电子,二者核外电子数不同,故A错误;
B.M与T形成的化合物是氧化铝,氧化铝是两性氧化物,溶于强酸、强碱,故B正确;
C.水分子之间存在氢键,故沸点H2O>H2S,故C正确;
D.金属性Mg>Be,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为Q<L,故D错误.
故选:BC.
点评 本题考查元素位置结构和性质的关系及应用,题目难度中等,根据化合价、原子半径推断元素是解答该题的关键,注意元素周期律的递变规律的应用.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
5.下列电子式正确的是( )
| A. | H2O2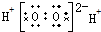 | B. | HClO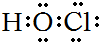 | C. | MgCl2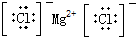 | D. | CCl4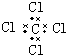 |
3.下列离子化合物的电子式书写不正确的是( )
| A. | 氯化钙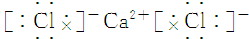 | B. | 硫化钠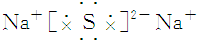 | ||
| C. | 氟化钾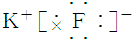 | D. | 过氧化钠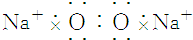 |
10.下列操作达不到预期目的是( )
①石油分馏时把温度计插入液面以下;②用溴水除去乙烯中混有的SO2气体;③用乙醇与3mol/L的H2SO4混合共热到170℃制取乙烯;④将苯和溴水混合后加入Fe粉制溴苯;⑤将饱和食盐水滴入盛有电石的烧瓶中制乙炔.
①石油分馏时把温度计插入液面以下;②用溴水除去乙烯中混有的SO2气体;③用乙醇与3mol/L的H2SO4混合共热到170℃制取乙烯;④将苯和溴水混合后加入Fe粉制溴苯;⑤将饱和食盐水滴入盛有电石的烧瓶中制乙炔.
| A. | ①④ | B. | ③⑤ | C. | ②③④⑤ | D. | ①②③④ |
20.下列各组比较中正确的是( )
| A. | 锂与水反应不如钠与水反应剧烈 | |
| B. | 还原性:K>Na>Li,故K可以从NaCl的水溶液中置换出金属钠 | |
| C. | Li、Na、K、Rb、Cs等碱金属单质都是银白色 | |
| D. | 碱性:LiOH>NaOH>KOH |
4.下列化学用语使用正确的是( )
| A. | NCl3的电子式: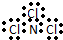 | B. | H- 的结构示意图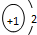 | ||
| C. | 含有4个中子的锂原子:74Li | D. | 次氯酸的结构式:H-Cl-O |
