题目内容
6.某金属若干克,其原子核外共有2mol电子,核内共有1.204×1024个中子;同质量的该金属跟足量稀盐酸反应,有0.2mol电子发生转移,生成6.02×1022个阳离子.则:该金属原子的组成符号为Ca;摩尔质量为40g/mol;原子核中,中子数有20个;质子数有20个.
分析 有0.2mol电子发生转移,生成6.02×1022个即0.1mol阳离子,说明金属的物质的量为0.1mol,原子核外共有2mol电子,则原子中电子数为$\frac{2mol}{0.1mol}$=20,中子数为=$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}}$=2,求出摩尔质量,摩尔质量在数值上近似等于质量数,利用质子数+中子数=质量数求出质子数,从而确定原子序数和元素符号.
解答 解:有0.2mol电子发生转移,生成6.02×1022个即0.1mol阳离子,说明金属的物质的量为0.1mol,原子核外共有2mol电子,则原子中电子数为$\frac{2mol}{0.1mol}$=20,电子数=质子数=原子序数=20,所以是Ca元素,中子数为=$\frac{\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}}}{0.1}$=20,质量数=质子数+中子数=40,摩尔质量在数值上和质量数相等,为40g/mol,
故答案为:Ca;40g/mol;20;20.
点评 本题考查了原子中的质子数、中子数以及电子数之间的关系、电子式的书写,题目难度不大,根据各微粒数之间的关系求出质子数确定元素是解题的关键.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
16.在8NH3+3Cl2→6NH4Cl+N2反应中,若有10.2gNH3被氧化,则反应用去的氯气在标准状况下体积为( )
| A. | 5.04L | B. | 6.72L | C. | 20.16L | D. | 40.32L |
1.下列关于稀有气体的叙述不正确的是( )
| A. | 原子的最外层电子排布不一定都是以p6结束 | |
| B. | 化学性质非常不活泼 | |
| C. | 其原子与同周期ⅠA、ⅡA族阳离子具有相同电子排布式 | |
| D. | 原子半径比同周期ⅦA族元素原子的大 |
11.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
| A. | SO2、CS2、HI都是直线形分子 | B. | BF3键角为120°,NH3键角大于120° | ||
| C. | BF3、SO3都是平面三角形分子 | D. | PCl3、NH3、PCl5都是三角锥形分子 |
18.从甜橙的芳香油中可分离得到如下结构的化合物: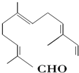 现有试剂:
现有试剂:
①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2碱性悬浊液,能与该化合物中所有官能团都发生反应的试剂有( )
 现有试剂:
现有试剂:①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2碱性悬浊液,能与该化合物中所有官能团都发生反应的试剂有( )
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
15.下表是部分短周期元素的原子半径及主要化合价,根据表中信息判断正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 氢化物的沸点为H2T>H2R | |
| D. | 单质与浓度相等的稀盐酸反应的剧烈程度为Q>L |
16.在光照下,将等物质的量的CH4和Cl2充分反应,得到产物的物质的量最多的是( )
| A. | HCl | B. | CH3Cl | C. | CHCl3 | D. | CCl4 |
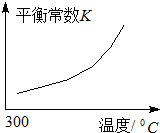 煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择. .
.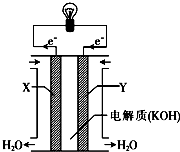 一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:
一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是: