题目内容
10.下列操作达不到预期目的是( )①石油分馏时把温度计插入液面以下;②用溴水除去乙烯中混有的SO2气体;③用乙醇与3mol/L的H2SO4混合共热到170℃制取乙烯;④将苯和溴水混合后加入Fe粉制溴苯;⑤将饱和食盐水滴入盛有电石的烧瓶中制乙炔.
| A. | ①④ | B. | ③⑤ | C. | ②③④⑤ | D. | ①②③④ |
分析 ①蒸馏时测量馏分温度;
②溴和乙烯、SO2都反应;
③用乙醇与浓硫酸H2SO4混合共热到170℃制取乙烯;
④将苯和液溴混合后加入Fe粉制溴苯;
⑤将饱和食盐水滴入盛有电石的烧瓶中制乙炔,用食盐水代替水能减缓反应速率.
解答 解:①蒸馏时测量馏分温度,温度计水银球应该位于蒸馏烧瓶支管口处,故错误;
②溴能和乙烯发生加成反应、能和二氧化硫发生氧化还原反应,所以溴和乙烯、SO2都反应,故错误;
③用乙醇与浓硫酸H2SO4混合共热到170℃制取乙烯,浓硫酸作催化剂和脱水剂,不能用稀硫酸,故错误;
④将苯和液溴混合后加入Fe粉制溴苯,苯和溴水不反应,但能萃取溴水中的溴,故错误;
⑤电石和水反应生成氢氧化钙和乙炔,为防止反应速率过快,将饱和食盐水滴入盛有电石的烧瓶中制乙炔,故正确;
故选D.
点评 本题考查化学实验方案评价,涉及反应速率影响因素、物质的制备、物质的分离和提纯等知识点,明确实验原理是解本题关键,从实验操作规范性及物质的性质进行评价,题目难度不大.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
20.某无色溶液加入铝可以生成氢气,则在该溶液中可能大量存在的离子组是( )
| A. | K+、NH4+、NO3-、Cl- | B. | Na+、K+、NH4+、Cl- | ||
| C. | NH4+、K+、HCO3-、Cl- | D. | Na+、Cu2+、Br-、Cl- |
1.下列关于稀有气体的叙述不正确的是( )
| A. | 原子的最外层电子排布不一定都是以p6结束 | |
| B. | 化学性质非常不活泼 | |
| C. | 其原子与同周期ⅠA、ⅡA族阳离子具有相同电子排布式 | |
| D. | 原子半径比同周期ⅦA族元素原子的大 |
18.从甜橙的芳香油中可分离得到如下结构的化合物: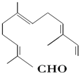 现有试剂:
现有试剂:
①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2碱性悬浊液,能与该化合物中所有官能团都发生反应的试剂有( )
 现有试剂:
现有试剂:①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2碱性悬浊液,能与该化合物中所有官能团都发生反应的试剂有( )
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
5.X元素最高价氧化物对应水化物化学式为H4XO4,则对应的氢化物化学式为( )
| A. | HX | B. | H2X | C. | XH3 | D. | XH4 |
15.下表是部分短周期元素的原子半径及主要化合价,根据表中信息判断正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 氢化物的沸点为H2T>H2R | |
| D. | 单质与浓度相等的稀盐酸反应的剧烈程度为Q>L |
2.为将反应2Al+6H+═2Al3++3H2↑的化学能转化为电能,下列装置能达到目的是(铝条均已除去了氧化膜)( )
| A. | 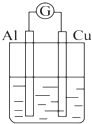 NaOH溶液 | B. | 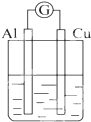 稀硫酸 | C. | 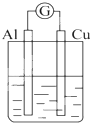 稀硝酸 | D. | 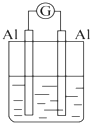 稀盐酸 |
19.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-═2AlO2-+H2O
(4)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(5)表示①与⑦的化合物的电子式 ,该化合物是由极性(填“极性”“非极性”下同)键形成的.
,该化合物是由极性(填“极性”“非极性”下同)键形成的.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-═2AlO2-+H2O
(4)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)表示①与⑦的化合物的电子式
 ,该化合物是由极性(填“极性”“非极性”下同)键形成的.
,该化合物是由极性(填“极性”“非极性”下同)键形成的.
20.已知酸性强弱顺序为H2CO3>C6H5OH>HCO3-,下列化学方程式正确的是( )
| A. | 2 C6H5ONa+H2O+CO2→2 C6H5OH+Na2CO3 | |
| B. | C6H5ONa+H2O+CO2→C6H5OH+NaHCO3 | |
| C. | C6H5OH+Na2CO3→C6H5ONa+NaHCO3 | |
| D. | C6H5OH+NaHCO3→C6H5ONa+H2CO3 |