题目内容
3.下列离子化合物的电子式书写不正确的是( )| A. | 氯化钙 | B. | 硫化钠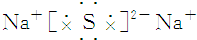 | ||
| C. | 氟化钾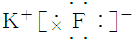 | D. | 过氧化钠 |
分析 从离子化合物和共价化合物的电子式书写方法确定电子式书写是否正确,用电子式表示离子键形成的物质的结构与表示共价键形成的物质的结构的不同点:(1)电荷:用电子式表示离子键形成的物质的结构需标出阳离子和阴离子的电荷;而表示共价键形成的物质的结构不能标电荷;(2)[](方括号):离子键形成的物质中的阴离子需用方括号括起来,而共价键形成的物质中不能用方括号.
解答 解:A、氯化钙为离子化合物,由钙离子与氯离子构成,电子式为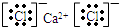 ,故A正确;
,故A正确;
B、硫化钠为离子化合物,由钠离子与硫离子构成,电子式为 ,故B正确;
,故B正确;
C、氟化钾为离子化合物,由钾离子与氟离子构成,电子式为 ,故C正确;
,故C正确;
D、过氧化钠为离子化合物,由钠离子与过氧根离子构成,电子式为 ,故D错误.
,故D错误.
故选D.
点评 本题考查电子式的判断,要明确用电子式表示离子化合物、共价化合物、阴离子及单质分子的方法,注意过氧根离子中有一对共用电子对.

练习册系列答案
相关题目
13.某短周期元素R原子的最外层P轨道上的未成对电子只有2个.下列关于R的描述中正确的是( )
| A. | R的氧化物都能溶于水 | |
| B. | R的最高价氧化物对应的水化物都是H2RO3 | |
| C. | R是非金属元素 | |
| D. | R的氧化物都能与NaOH溶液反应 |
11.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
| A. | SO2、CS2、HI都是直线形分子 | B. | BF3键角为120°,NH3键角大于120° | ||
| C. | BF3、SO3都是平面三角形分子 | D. | PCl3、NH3、PCl5都是三角锥形分子 |
18.从甜橙的芳香油中可分离得到如下结构的化合物: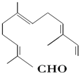 现有试剂:
现有试剂:
①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2碱性悬浊液,能与该化合物中所有官能团都发生反应的试剂有( )
 现有试剂:
现有试剂:①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2碱性悬浊液,能与该化合物中所有官能团都发生反应的试剂有( )
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
8.下列有机物的命名正确的是( )
| A. | (CH3)2CHCH2CH(CH3)CH(CH3)2 2,4,5-三甲基己烷 | |
| B. | 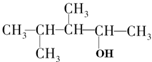 1,2,3-三甲基-1-丁醇 1,2,3-三甲基-1-丁醇 | |
| C. | CH2=C(CH3)CH2C(CH3)32,4,4-三甲基-1-戊烯 | |
| D. | CH3COOCH2CH2OOCCH3 乙二酸乙二酯 |
15.下表是部分短周期元素的原子半径及主要化合价,根据表中信息判断正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 氢化物的沸点为H2T>H2R | |
| D. | 单质与浓度相等的稀盐酸反应的剧烈程度为Q>L |
 一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:
一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是: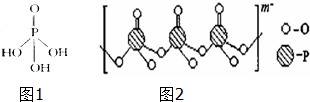 磷单质及其化合物在工业生产巾有着广泛的应用.向磷可用于制备高纯度的磷酸(磷酸结构简式如图1),三聚磷酸钠是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:
磷单质及其化合物在工业生产巾有着广泛的应用.向磷可用于制备高纯度的磷酸(磷酸结构简式如图1),三聚磷酸钠是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空: