题目内容
【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-水解程度增大,故碱性增强,该反应的离子方程式为______________________。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3(填“大于”或“小于”)。丙同学认为甲、乙的判断都不充分,丙认为:
(2)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)判断正确。试剂X是________(填选项)。
A.Ba(OH)2溶液 | B.BaCl2溶液 |
C.NaOH溶液 | D.澄清的石灰水 |
(3)查阅资料发现NaHCO3的分解温度为150℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是________________________________________________。
【答案】HCO3-+H2O![]() H2CO3+OH- 大于 乙 B 乙 常压下加热NaHCO3的水溶液,溶液温度达不到150 ℃
H2CO3+OH- 大于 乙 B 乙 常压下加热NaHCO3的水溶液,溶液温度达不到150 ℃
【解析】
(1)甲认为碳酸氢钠是强碱弱酸的酸式盐,能水解导致溶液呈碱性,水解方程式为HCO3-+H2O![]() H2CO3+OH-。碳酸钠是强碱弱酸盐,能水解,因为碳酸根离子的水解第一步远远大于第二步,所以碳酸钠的水解程度大于碳酸氢钠的水解程度。
H2CO3+OH-。碳酸钠是强碱弱酸盐,能水解,因为碳酸根离子的水解第一步远远大于第二步,所以碳酸钠的水解程度大于碳酸氢钠的水解程度。
(2)碳酸氢钠和氯化钡不反应,但碳酸钠和氯化钡能反应生成白色沉淀碳酸钡,向碳酸氢钠或碳酸钠中加氢氧化钡或氢氧化钙都反应生成白色沉淀,向碳酸钠或碳酸氢钠中加入氢氧化钠虽然反应但不产生明显现象。
(3)碳酸氢钠的分解温度为150℃,常压下加入碳酸氢钠溶液,溶液的温度不能达到150℃,所以碳酸氢钠不分解,溶液仍为碳酸氢钠溶液,由此判断乙是错误的。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】下列有关水溶液中的平衡相关的问题,请填空
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式______________
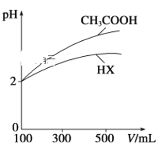
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中![]() =____。
=____。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。