题目内容
【题目】Ⅰ.十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(C10H18)→四氢萘(C10H12)→萘(C10H8)”的脱氢过程释放氢气。
已知:C10H18(l)![]() C10H12(l)+3H2(g) ΔH1
C10H12(l)+3H2(g) ΔH1
C10H12(l)![]() C10H8(l)+2H2(g) ΔH2
C10H8(l)+2H2(g) ΔH2
ΔH1>ΔH2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢萘的常压沸点为192℃;在192℃,液态十氢萘的脱氢反应的平衡转化率约为9%。
请回答:
(1)有利于提高上述反应平衡转化率的条件是___。
A.高温高压 B.低温低压
C.高温低压 D.低温高压
(2)研究表明,将适量的十氢萘置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是___。
(3)温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00mol)催化脱氢实验(两步反应都使用了催化剂),测得C10H12和C10H8的产率x1和x2(以物质的量分数计)随时间的变化关系,如图1所示。
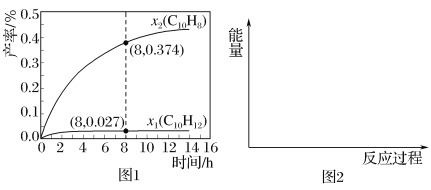
①在8h时,反应体系内氢气的量为___mol(忽略其他副反应)。
②x1显著低于x2的原因是___。
③在图2中绘制“C10H18→C10H12→C10H8”的“能量—反应过程”示意图___。
Ⅱ.(1)科学家发现,以H2O和N2为原料,熔融NaOH—KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。
电极反应式:___和2Fe+3H2O+N2=Fe2O3+2NH3。
(2)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol·L-1,电离常数Ka1=1.54×10-2,Ka2=1.02×10-7。向10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL。当V=amL时,溶液中离子浓度有如下关系:c(Na+)=2c(SO32-)+c(HSO3-);当V=bmL时,溶液中离子浓度有如下关系:c(Na+)=c(SO32-)+c(HSO32-)+c(H2SO3);则a___(填“大于”“小于”或“等于”)b。
【答案】C 是反应吸热,温度升高,平衡正向移动,与此同时,温度升高导致十氢萘汽化,浓度增大,平衡正向移动,生成氢气量显著增加 1.951 催化剂显著降低了C10H12到C10H8的活化能,反应生成C10H12迅速转变为C10H8,使C10H12不能积累 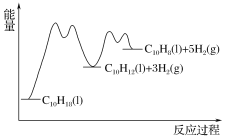 Fe2O3+6e-+3H2O=2Fe+6OH- 大于
Fe2O3+6e-+3H2O=2Fe+6OH- 大于
【解析】
Ⅰ.(1)根据平衡移动原理分析平衡转化率的变化;
(2)升高温度平衡正向移动;
(3)①根据方程式C10H18(l)![]() C10H12(l)+3H2(g)、C10H18(l)
C10H12(l)+3H2(g)、C10H18(l)![]() C10H8(l)+5H2(g)计算氢气的物质的量;
C10H8(l)+5H2(g)计算氢气的物质的量;
②x1显著低于x2说明C10H12(l)![]() C10H8(l)+2H2(g)反应快;
C10H8(l)+2H2(g)反应快;
③C10H12(l)![]() C10H8(l)+2H2(g)速率快,活化能小;
C10H8(l)+2H2(g)速率快,活化能小;
Ⅱ.(1)阴极反应是![]() ;
;
(2)根据电荷守恒,可判断当c(Na+)=2c(SO32-)+c(HSO3-),溶液呈中性;根据物料守恒,可判断当c(Na+)=c(SO32-)+c(HSO32-)+c(H2SO3)时,溶质为NaHSO3;
(1)A. 正反应的气体物质的量增大,加压平衡逆向移动,平衡转化率降低,故不选A;
B. 正反应吸热,降低温度,平衡逆向移动,平衡转化率降低,故不选B;
C. 正反应的气体物质的量增大,降低压强,平衡正向移动,正反应吸热,升高温度,平衡正向移动,高温低压,平衡转化率增大,故选C;
D. 正反应吸热,降低温度,平衡逆向移动,平衡转化率降低,正反应气体物质的量增大,加压平衡逆向移动,平衡转化率降低,故不选D;选C。
(2)正反应吸热,温度升高,平衡正向移动,与此同时,温度升高导致十氢萘汽化,浓度增大,平衡正向移动,故生成氢气量显著增加;
(3)①根据图示,在8h时,C10H12(g)的物质的量是1mol×0.027=0.027mol,则C10H18(l)![]() C10H12(l)+3H2(g)反应生成氢气的物质的量是0.027mol×3=0.081mol,C10H8 (g)的物质的量是0.374mol,则C10H18(l)
C10H12(l)+3H2(g)反应生成氢气的物质的量是0.027mol×3=0.081mol,C10H8 (g)的物质的量是0.374mol,则C10H18(l)![]() C10H8(l)+5H2(g) 反应生成氢气的物质的量是0.374mol×5=1.87mol,容器中氢气的物质的量是1.87mol+0.081mol=1.951mol;
C10H8(l)+5H2(g) 反应生成氢气的物质的量是0.374mol×5=1.87mol,容器中氢气的物质的量是1.87mol+0.081mol=1.951mol;
②x1显著低于x2说明C10H12(l)![]() C10H8(l)+2H2(g)反应快,催化剂显著降低了C10H12到C10H8的活化能,反应生成C10H12迅速转变为C10H8,使C10H12不能积累;
C10H8(l)+2H2(g)反应快,催化剂显著降低了C10H12到C10H8的活化能,反应生成C10H12迅速转变为C10H8,使C10H12不能积累;
③C10H18→C10H12→C10H8反应放热,C10H12(l)![]() C10H8(l)+2H2(g)速率快,活化能小,所以“C10H18→C10H12→C10H8”的“能量—反应过程”示意图是
C10H8(l)+2H2(g)速率快,活化能小,所以“C10H18→C10H12→C10H8”的“能量—反应过程”示意图是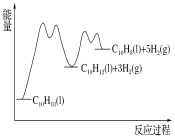 ;
;
Ⅱ.(1)阴极反应是![]() ,减去2Fe+3H2O+N2=Fe2O3+2NH3得第一步反应式为Fe2O3+6e-+3H2O=2Fe+6OH-;
,减去2Fe+3H2O+N2=Fe2O3+2NH3得第一步反应式为Fe2O3+6e-+3H2O=2Fe+6OH-;
(2)根据电荷守恒,c(Na+)+ c(H+)=2c(SO32-)+c(HSO3-)+(OH-),当c(Na+)=2c(SO32-)+c(HSO3-)时c(H+)= (OH-),溶液呈中性;根据物料守恒,可判断当c(Na+)=c(SO32-)+c(HSO32-)+c(H2SO3),溶质为NaHSO3,亚硫酸的电离平衡常数Ka1=1.54×10-2,Ka2=1.02×10-7,可知HSO3-电离大于水解,NaHSO3溶液呈酸性,所以a大于b。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】研究氮及其化合物对化工生产有重要意义。
(1)已知:①N2(g)+O2(g)=2NO(g) ΔH1
②2NH3(g)![]() N2(g)+3H2(g) △H2
N2(g)+3H2(g) △H2
③2H2(g)+O2(g)=2H2O(g) △H3
则热化学方程式:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=__(用△H1、△H2、△H3表示)。
(2)在2L密闭绝热容器中,投入4mol N2和6mol H2,在一定条件下生成NH3,测得不同温度下,平衡时NH3的物质的量数据如下表:
温度/K | T1 | T2 | T3 | T4 |
n(NH3)/mol | 3.6 | 3.2 | 2.8 | 2.0 |
①下列能说明该反应已达到平衡状态的是__。
A.3v正(H2)=2v逆(NH3) B.容器内气体压强不变
C.混合气体的密度不变 D.混合气的温度保持不变
②温度T1__(填“>”<”或“=”)T3。
③在T3温度下,达到平衡时N2的转化率为__。
(3)N2O4为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) △H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为__(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强110kPa),已知该条件下k逆=5×102kPa-1·s-1,当N2O4分解10%时,v逆=__kPa·s-1。
2NO2(g) △H。上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则该反应的化学平衡常数Kp为__(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强110kPa),已知该条件下k逆=5×102kPa-1·s-1,当N2O4分解10%时,v逆=__kPa·s-1。
(4)以连二亚硫酸盐(S2O42-)为还原剂脱除烟气中的NO,并通过电解再生,装置如图。阴极的电极反应式为__,电解槽中的隔膜为__(填“阳”或“阴”)离子交换膜。每处理1mol NO,电路中通过电子的物质的量为__。

【题目】电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为__________________。
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________。
(4)25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=___________。