题目内容
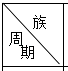
【题目】表是周期表中的一部分,根据A﹣I的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | F | G | I | |||
3 | B | C | H |
(1)表中元素,化学性质最不活泼的是 .
(2)A﹣I元素中,非金属性最强的元素与金属性最强的元素形成的物质是 , 该物质的熔点比干冰的熔点(填“低”或“高”).
(3)比较D,E最高价氧化物的水化物酸性强弱 .
(4)G,H的氢化物沸点较高的是 , 理由是 .
(5)A,E,H组成的常见物质的电子式为 .
(6)用电子式表示E的氢化物的形成过程 .
【答案】
(1)Ne
(2)Na;高
(3)HNO3>H2CO3
(4)HF;HF分子间含氢键
(5)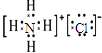
(6)3H?+ ![]() →
→ ![]()
【解析】解:由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为O,G为F,H为Cl,I为Ne,(1)以上元素中,只有Ne的最外层电子为8,为稳定结构,则化学性质不活泼,所以答案是:Ne;(2)F的非金属性最强,Na的金属性最强,二者形成离子化合物NaF,该物质的熔点比干冰的熔点高,所以答案是:NaF;高;(3)非金属性越强,最高价氧化物的水化物酸性越强,则酸性为HNO3>H2CO3 , 所以答案是:HNO3>H2CO3;(4)G、H的氢化物沸点较高的是HF,理由是HF分子间含氢键,所以答案是:HF;HF分子间含氢键;(5)A、E、H组成的常见物质为氯化铵,其电子式为 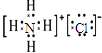 ,所以答案是:
,所以答案是: 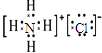 ;(6)E的氢化物为氨气,为共价化合物,用电子式表示形成过程为3H+
;(6)E的氢化物为氨气,为共价化合物,用电子式表示形成过程为3H+ ![]() →
→ 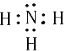 ,所以答案是:3H+
,所以答案是:3H+ ![]() →
→ 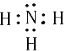 .
.

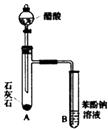
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。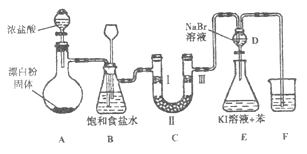
(1)装置A是氯气的发生装置,请写出该反应相应的化学方程式:。
(2)装置B中饱和食盐水的作用是;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入物质的组合应是(填字母编号)。
编号 | I | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 , 该现象(填“能”或“不能”) 说明溴单质的氧化性强于碘,原因是。
(5)装置F的烧杯中的溶液不能选用下列中的(填字母编号)。a.饱和NaOH溶液 b.饱和Ca(OH)2溶液 c.饱和Na2CO3溶液