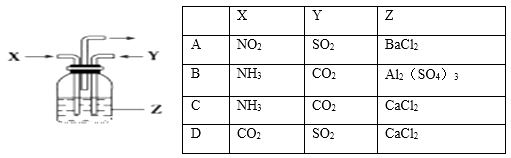
题目内容
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=﹣lgc(M),p(CO32﹣)=﹣lgc(CO32﹣).下列说法正确的是( ) 
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)>c(CO32﹣)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32﹣)
D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32﹣)
【答案】C
【解析】解:A.pM相等时,图线中p(CO32﹣)数值越大,实际浓度越小,因此,MgCO3、CaCO3、MnCO3 的Ksp依次减小,故A错误; B.a点可表示MnCO3的饱和溶液,pM=p(CO32﹣),所以c(Mn2+)=c(CO32﹣),故B错误;
C.b点可表示CaCO3的饱和溶液,pM>p(CO32﹣),所以c(Ca2+)<c(CO32﹣),故C正确;
D.pM数值越小,实际浓度越大,已知c点不在曲线上,而在曲线下面,则c点表示MgCO3 的过饱和溶液,pM>p(CO32﹣),所以c(Mg2+)<c(CO32﹣),故D错误;
故选:C.
A.pM相等时,图线中p(CO32﹣)数值越大,实际浓度越小;
B.a点可表示MnCO3的饱和溶液,pM=p(CO32﹣);
C.b点可表示CaCO3的饱和溶液,pM>p(CO32﹣);
D.pM数值越大,实际浓度越小,则c点可表示MgCO3 的不饱和溶液,pM>p(CO32﹣).

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
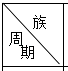
智趣寒假作业云南科技出版社系列答案【题目】表是周期表中的一部分,根据A﹣I的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | F | G | I | |||
3 | B | C | H |
(1)表中元素,化学性质最不活泼的是 .
(2)A﹣I元素中,非金属性最强的元素与金属性最强的元素形成的物质是 , 该物质的熔点比干冰的熔点(填“低”或“高”).
(3)比较D,E最高价氧化物的水化物酸性强弱 .
(4)G,H的氢化物沸点较高的是 , 理由是 .
(5)A,E,H组成的常见物质的电子式为 .
(6)用电子式表示E的氢化物的形成过程 .