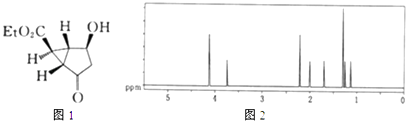
题目内容
【题目】某Na2O2 固体中因吸收CO2 而含有少量Na2CO3,经实验测定样品中Na2O2的质量分数为88.0%。现称取该样品8.86g,加入水充分反应后放出气体,所得溶液体积为500mL。试计算:(要求:写出解题过程,计算结果保留两位小数)
(1)上述反应所得气体在标准状况下的体积;_________
(2)反应后溶液中Na+的物质的量浓度。_______________
【答案】 1.12L 0.44mol/L
【解析】(1)过氧化钠的物质的量: ![]() ,依据方程式:2Na2O2+2H2O=4NaOH+O2↑,可知生成氧气的物质的量为
,依据方程式:2Na2O2+2H2O=4NaOH+O2↑,可知生成氧气的物质的量为![]() ,标况下气体的体积为:0.05mol×22.4L/mol=1.12L;(2)样品中含有碳酸钠的物质的量为:
,标况下气体的体积为:0.05mol×22.4L/mol=1.12L;(2)样品中含有碳酸钠的物质的量为: ![]() ,依据钠原子守恒,反应后溶液中钠离子的物质的量为:(0.10mol+0.01mol)×2=0.22mol,溶液体积为0.5L,所以钠离子的物质的量浓度
,依据钠原子守恒,反应后溶液中钠离子的物质的量为:(0.10mol+0.01mol)×2=0.22mol,溶液体积为0.5L,所以钠离子的物质的量浓度![]() 。
。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】表是周期表中的一部分,根据A﹣I的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | F | G | I | |||
3 | B | C | H |
(1)表中元素,化学性质最不活泼的是 .
(2)A﹣I元素中,非金属性最强的元素与金属性最强的元素形成的物质是 , 该物质的熔点比干冰的熔点(填“低”或“高”).
(3)比较D,E最高价氧化物的水化物酸性强弱 .
(4)G,H的氢化物沸点较高的是 , 理由是 .
(5)A,E,H组成的常见物质的电子式为 .
(6)用电子式表示E的氢化物的形成过程 .