题目内容
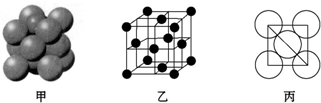
2. 常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )
常温下,用0.1000mol•L-1NaOH溶液分别滴定20.00mL0.1000mol•L-1盐酸和20.00mL 0.1000mol•L-1醋酸溶液,得到2条滴定曲线,如图所示.若以HX表示酸,下列说法正确的是( )| A. | 滴定盐酸的曲线是图乙 | |
| B. | 达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(X-) | |
| C. | 达到B、E状态时,反应消耗的,n(CH3COOH)>n(HCl) | |
| D. | 当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(X-)>c(Na+)>c(H+)>c(OH-) |
分析 A.醋酸是弱电解质、HCl是强电解质,物质的量浓度相等的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,则pH醋酸>盐酸;
B.中性溶液中存在c(H+)=c(OH-),根据电荷守恒判断c(Na+)、c(X-)大小;
C.两种酸的物质的量浓度相等,其体积相等时物质的量相等;
D.当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸.
解答 解:A.醋酸是弱电解质、HCl是强电解质,物质的量浓度相等的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,则pH醋酸>盐酸,根据图象知,甲是滴定盐酸、乙是滴定醋酸,故A错误;
B.中性溶液中存在c(H+)=c(OH-),根据电荷守恒得c(Na+)=c(X-),故B正确;
C.两种酸的物质的量浓度相等,其体积相等时物质的量相等,所以n(CH3COOH)=n(HCl),故C错误;
D.当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A-)>c(H+)>c(Na+)>c(OH-),故D错误,故D错误;
故选B.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查弱电解质电离及溶液离子浓度大小比较,易错选项是D,注意利用溶液中的溶质及其量的多少判断.

练习册系列答案
相关题目
12.常温下,下列对于溶液问题的叙述正确的是( )
| A. | pH=4的氯化铵溶液,用蒸馏水稀释10倍后,溶液的pH=5 | |
| B. | pH=3的盐酸与pH=3的CH3COOH溶液相比,c(Cl-)>C(CH3COO-) | |
| C. | pH=2的一元酸HA溶液与pH=12的NaOH溶液以体积比1:1混合后,c(Na+)≤c(A-) | |
| D. | pH相同的NaOH、NaClO两种溶液中水的电离程度相同 |
13.(1)室温时纯水中 c(H+)=c(OH-),向纯水中加入少量下列固体物质:
A、NaOH B、Na2SO4 C、NH4Cl
试回答如下问题:
Ⅰ.溶液中H+、OH-浓度变化情况(填“增大”、“减少”、“不变”);
Ⅱ.c(H+)与 c(OH-)大小比较(填“>”、“<”、“=”);
Ⅲ.溶液的酸碱性(填“酸性”、“碱性”、“中性”);
请按上述要求补充完整表中相关内容:
(2)已知25℃合成氨反应中,1molN2完全转化为NH3时释放的能量为92.4kJ.现将1molN2和3molH2混全置于2L密闭容器中,反应进行到2s末测得NH3为0.4mol.试回答:
①该反应的热化学方方程式为N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
②该反应达到平衡后,升高温度平衡向逆 (填“正”、“逆”)反应方向移动;增大压强平衡向正 (填“正”、“逆”)反应方向移动;加入催化剂平衡不能(填“能”、“不能”)移动;
③前2s内v(H2)为0.15mol/(L•s).
A、NaOH B、Na2SO4 C、NH4Cl
试回答如下问题:
Ⅰ.溶液中H+、OH-浓度变化情况(填“增大”、“减少”、“不变”);
Ⅱ.c(H+)与 c(OH-)大小比较(填“>”、“<”、“=”);
Ⅲ.溶液的酸碱性(填“酸性”、“碱性”、“中性”);
请按上述要求补充完整表中相关内容:
| A、NaOH | B、Na2SO4 | C、NH4Cl | |
| c(H+) | 减小 | ① | 增 大 |
| c(OH-) | ② | 不 变 | ③ |
| c(H+)与c(OH-)的大小比较 | ④ | = | > |
| 溶液的酸碱性 | 碱 性 | ⑤ | 酸 性 |
①该反应的热化学方方程式为N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
②该反应达到平衡后,升高温度平衡向逆 (填“正”、“逆”)反应方向移动;增大压强平衡向正 (填“正”、“逆”)反应方向移动;加入催化剂平衡不能(填“能”、“不能”)移动;
③前2s内v(H2)为0.15mol/(L•s).
7.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,8g CH4含有4NA个氢原子 | |
| B. | 1mol Cu与足量FeCl3溶液反应,转移2NA个电子 | |
| C. | 1L0.1 mol•L-1(NH4)2SO4溶液中含有0.2NA个NH4+ | |
| D. | 10 L pH=l的硫酸溶液中含有的H+离子数为2NA |
14.下列有关${\;}_{8}^{16}$O2的说法正确的是( )
| A. | ${\;}_{8}^{18}$O2是${\;}_{8}^{16}$O2的同分异构体 | |
| B. | ${\;}_{8}^{18}$O2是O3的一种同素异形体 | |
| C. | ${\;}_{8}^{18}$O2与${\;}_{8}^{16}$O2互为同位素 | |
| D. | 1mol ${\;}_{8}^{18}$O2分子中含有20mol电子 |
11.某化学兴趣小组对碳、氮、磷等常见元素的化合物性质进行如下研究.请按要求回答问题.
(1)甲同学用图l所示装置(部分夹持装置略)探究NO与Na2O2的反应.
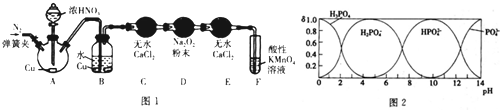
查阅资料:
2NO+Na2O2═2NaNO2
6NaNO2+3H2SO4═3Na2SO4+2HNO3+4NO↑+2H2O
酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2-
①A中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O.B中观察到的主要现象是铜片逐渐溶解,溶液变为蓝色,有无色气泡产生,F装置的作用是吸收未反应的NO.
②在反应前,打开弹簧夹,通入一段时间N2,目的是将装置中的空气排净.
③充分反应后,检验D装置中发生反应的实验是取D装置中是产物少许于试管中,加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠.
(2)乙同学查阅有关弱酸的电离平衡常数:
则该温度下相同pH的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的物质的量浓度由大到小的顺序为a>d>b>c(填编号).
(3)磷酸(H3PO4)为一种三元酸,其在水溶液中各种存在形式物质的量分数(δ) 随pH的变化曲线如图2:
①Na3PO4溶液中,C(Na+)/c(PO43-)>3(填“>”“=”或“<”).向Na3PO4,溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为HPO42-+H+=H2PO4-.
②由图推断NaH2PO4溶液中各种微粒浓度关系是AD.(填选项字母)
A.c(Na-)>c(H2PO4-)>c(H+)>c(HPO42-)>c(H3PO4)
B.c(Na+)>c(H2PO4-)>c(OH-)>c(H3PO4)>c(HPO42-)
C.c(H-)+c(Na-)=c(OH)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(H3PO4)
D.c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4)
③假设在25℃时测得0.1mol•L-1Na3PO4溶液的pH=12,近似计算出Na3PO4第一步水解的水解常数(用Kh表示) Kh=1.1×10 -3mol•L-1(忽略Na3PO4第二、第三步水解,结果保留两位有效数字).
(1)甲同学用图l所示装置(部分夹持装置略)探究NO与Na2O2的反应.

查阅资料:
2NO+Na2O2═2NaNO2
6NaNO2+3H2SO4═3Na2SO4+2HNO3+4NO↑+2H2O
酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2-
①A中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O.B中观察到的主要现象是铜片逐渐溶解,溶液变为蓝色,有无色气泡产生,F装置的作用是吸收未反应的NO.
②在反应前,打开弹簧夹,通入一段时间N2,目的是将装置中的空气排净.
③充分反应后,检验D装置中发生反应的实验是取D装置中是产物少许于试管中,加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠.
(2)乙同学查阅有关弱酸的电离平衡常数:
| 化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×108 | 4.9×10-10 | K1=4.3×10-7 K1=5.6×10-11 |
(3)磷酸(H3PO4)为一种三元酸,其在水溶液中各种存在形式物质的量分数(δ) 随pH的变化曲线如图2:
①Na3PO4溶液中,C(Na+)/c(PO43-)>3(填“>”“=”或“<”).向Na3PO4,溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为HPO42-+H+=H2PO4-.
②由图推断NaH2PO4溶液中各种微粒浓度关系是AD.(填选项字母)
A.c(Na-)>c(H2PO4-)>c(H+)>c(HPO42-)>c(H3PO4)
B.c(Na+)>c(H2PO4-)>c(OH-)>c(H3PO4)>c(HPO42-)
C.c(H-)+c(Na-)=c(OH)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(H3PO4)
D.c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4)
③假设在25℃时测得0.1mol•L-1Na3PO4溶液的pH=12,近似计算出Na3PO4第一步水解的水解常数(用Kh表示) Kh=1.1×10 -3mol•L-1(忽略Na3PO4第二、第三步水解,结果保留两位有效数字).
 .
.