题目内容
16.常温下,下列溶液中的pH判断或各微粒浓度关系,不正确的是( )| A. | 将5mL0.02mol/L的H2SO4溶液与5mL0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH=2 | |
| B. | 将0.2mol/L的某一元酸HA溶液和0.1mol/LNaOH溶液等体积混合,混合液pH大于7,则反应后的混合液中:c(OH-)+c(A-)>c(H+)+c(HA) | |
| C. | pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:①>③>② | |
| D. | 常温下,0.1mol/L的CH3COONa和NaClO的混合溶液中:c(OH-)-c(H+)=c(HClO)+c(CH3COOH) |
分析 A.首先判断过量问题,然后计算溶液的中c(H+),再计算出溶液的pH;
B.反应后溶质为等浓度的NaA和HA,混合液的pH大于7,则A-的水解程度大于HA的电离程度,然后结合电荷守恒和物料守恒判断;
C.对应酸的酸性越弱,酸根离子的水解程度越强,溶液的pH越大,已知酸性:c(CH3COOH)>c(H2CO3)>c(C6H5OH),据此判断pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液的浓度关系及钠离子浓度;
D.根据混合液中的质子守恒判断.
解答 解:A.常温下将5mL0.02mol/LNaOH溶液与5mL0.02mol/LH2SO4溶液充分混合,硫酸过量,反应后c(H+)=$\frac{0.005L×2×0.02mol/L-0.005L×0.02mol/L}{0.005L+0.005L}$=0.01mol/L,则pH=2,故A正确;
B.二者混合后溶液中的溶质是等物质的量浓度的HA和NaA,溶液呈碱性,则:c(OH-)>c(H+),说明A-的水解程度大于HA电离程度,则溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(OH-)+c(A-)=c(H+)+c(Na+),根据物料守恒得2c(Na+)=c(A-)+c(HA),二者结合可得:2c(OH-)+c(A-)=2c(H+)+c(HA),由于c(OH-)>c(H+),则c(OH-)+c(A-)<c(H+)+c(HA),故B错误;
C.酸性大小为:c(CH3COOH)>c(H2CO3)>c(C6H5OH),则等浓度的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液的pH大小为:c(CH3COONa)<c(NaHCO3)<c(C6H5ONa),则①CH3COONa ②C6H5ONa ③NaHCO3溶液的浓度关系为:c(CH3COONa)>c(NaHCO3)>c(C6H5ONa),由于钠离子不水解,则钠离子浓度大小为:①>③>②,故C正确;
D.常温下,0.1mol/L的CH3COONa和NaClO的混合溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HClO)+c(CH3COOH),整理可得:c(OH-)-c(H+)=c(HClO)+c(CH3COOH),故D正确;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及酸碱混合的定性判断及溶液pH的计算、盐的水解原理、离子浓度大小比较等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力.

| A. | 将CO2通过Na2O2使其增重a g时,反应中转移电子数为$\frac{a{N}_{A}}{14}$ | |
| B. | 将1mol Cl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| C. | 常温常压下,3.0 g 含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA | |
| D. | 2.24L的CH4中含有的C-H键数为0.4NA |
| A. | 常温常压下,8g CH4含有4NA个氢原子 | |
| B. | 1mol Cu与足量FeCl3溶液反应,转移2NA个电子 | |
| C. | 1L0.1 mol•L-1(NH4)2SO4溶液中含有0.2NA个NH4+ | |
| D. | 10 L pH=l的硫酸溶液中含有的H+离子数为2NA |
(1)甲同学用图l所示装置(部分夹持装置略)探究NO与Na2O2的反应.
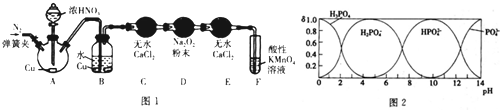
查阅资料:
2NO+Na2O2═2NaNO2
6NaNO2+3H2SO4═3Na2SO4+2HNO3+4NO↑+2H2O
酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2-
①A中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O.B中观察到的主要现象是铜片逐渐溶解,溶液变为蓝色,有无色气泡产生,F装置的作用是吸收未反应的NO.
②在反应前,打开弹簧夹,通入一段时间N2,目的是将装置中的空气排净.
③充分反应后,检验D装置中发生反应的实验是取D装置中是产物少许于试管中,加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠.
(2)乙同学查阅有关弱酸的电离平衡常数:
| 化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×108 | 4.9×10-10 | K1=4.3×10-7 K1=5.6×10-11 |
(3)磷酸(H3PO4)为一种三元酸,其在水溶液中各种存在形式物质的量分数(δ) 随pH的变化曲线如图2:
①Na3PO4溶液中,C(Na+)/c(PO43-)>3(填“>”“=”或“<”).向Na3PO4,溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为HPO42-+H+=H2PO4-.
②由图推断NaH2PO4溶液中各种微粒浓度关系是AD.(填选项字母)
A.c(Na-)>c(H2PO4-)>c(H+)>c(HPO42-)>c(H3PO4)
B.c(Na+)>c(H2PO4-)>c(OH-)>c(H3PO4)>c(HPO42-)
C.c(H-)+c(Na-)=c(OH)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(H3PO4)
D.c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4)
③假设在25℃时测得0.1mol•L-1Na3PO4溶液的pH=12,近似计算出Na3PO4第一步水解的水解常数(用Kh表示) Kh=1.1×10 -3mol•L-1(忽略Na3PO4第二、第三步水解,结果保留两位有效数字).
| A. | 向碘化亚铁溶液中通入过量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- | |
| B. | 将少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O→2C6H5OH+SO32- | |
| C. | 用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O | |
| D. | 工业上可用电解法制备Mg:2MgO$\frac{\underline{\;熔融\;}}{电解}$2Mg+O2↑ |
| A. | 常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA | |
| B. | 标准状况下,22.4L四氯化碳中所含有的Cl原子数目为4NA | |
| C. | 标准状况下,22.4升H2O中所含分子数大于NA | |
| D. | 常温常压下,33.6L氯气与56 g铁充分反应,转移的电子数为3NA |
| A. | 酸性氧化物的性质 | B. | 漂白性 | ||
| C. | 氧化性 | D. | 还原性 |