题目内容
6.化学与科学、技术、社会、环境密切相关.下列有关说法中不正确的是( )| A. | 氨气液化以及液氨气化要吸热,所以氨常用于制冷剂 | |
| B. | 做红烧鱼时,常加一些食醋和料酒会更香,是因为生成少量的酯 | |
| C. | “地沟油”经过加工处理后可以用来制肥皂 | |
| D. | 利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 |
分析 A、氨气的沸点高,易液化;
B、食醋和酒发生酯化反应生成有香味的酯类物质;
C、地沟油主要成分为高级脂肪酸甘油酯,碱性条件下水解为皂化反应;
D、氮和磷是植物的营养元素.
解答 解:A、氨气的沸点高,液化放热后气化吸热,则液氨气化吸收大量的热,所以液氨常用作制冷剂,故A错误;
B、食醋和酒发生酯化反应生成有香味的酯类物质,则红烧鱼更香,故B正确;
C、地沟油主要成分为高级脂肪酸甘油酯,碱性条件下水解生成高级脂肪酸盐,即为肥皂的主要成分,故C正确;
D、氮和磷是植物的营养元素,可造成水体富营养化,故D正确;
故选A.
点评 本题考查了氨气性质分析,酯化反应、酯的水解,注意化学知识的积累,掌握基础是解题关键,题目较简单.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
16.下列有关化学反应速率与化学反应限度的叙述中,错误的是( )
| A. | 化学反应速率是表示化学反应快慢的物理量 | |
| B. | 一般情况下,升高温度能加快化学反应速率 | |
| C. | 可逆反应达到化学反应限度时,反应就静止不动了 | |
| D. | 可逆反应达到化学反应限度时,正反应速率等于逆反应速率 |
14.下列有关${\;}_{8}^{16}$O2的说法正确的是( )
| A. | ${\;}_{8}^{18}$O2是${\;}_{8}^{16}$O2的同分异构体 | |
| B. | ${\;}_{8}^{18}$O2是O3的一种同素异形体 | |
| C. | ${\;}_{8}^{18}$O2与${\;}_{8}^{16}$O2互为同位素 | |
| D. | 1mol ${\;}_{8}^{18}$O2分子中含有20mol电子 |
11.某化学兴趣小组对碳、氮、磷等常见元素的化合物性质进行如下研究.请按要求回答问题.
(1)甲同学用图l所示装置(部分夹持装置略)探究NO与Na2O2的反应.
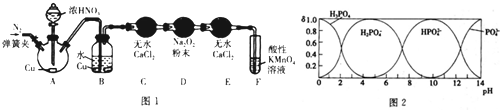
查阅资料:
2NO+Na2O2═2NaNO2
6NaNO2+3H2SO4═3Na2SO4+2HNO3+4NO↑+2H2O
酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2-
①A中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O.B中观察到的主要现象是铜片逐渐溶解,溶液变为蓝色,有无色气泡产生,F装置的作用是吸收未反应的NO.
②在反应前,打开弹簧夹,通入一段时间N2,目的是将装置中的空气排净.
③充分反应后,检验D装置中发生反应的实验是取D装置中是产物少许于试管中,加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠.
(2)乙同学查阅有关弱酸的电离平衡常数:
则该温度下相同pH的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的物质的量浓度由大到小的顺序为a>d>b>c(填编号).
(3)磷酸(H3PO4)为一种三元酸,其在水溶液中各种存在形式物质的量分数(δ) 随pH的变化曲线如图2:
①Na3PO4溶液中,C(Na+)/c(PO43-)>3(填“>”“=”或“<”).向Na3PO4,溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为HPO42-+H+=H2PO4-.
②由图推断NaH2PO4溶液中各种微粒浓度关系是AD.(填选项字母)
A.c(Na-)>c(H2PO4-)>c(H+)>c(HPO42-)>c(H3PO4)
B.c(Na+)>c(H2PO4-)>c(OH-)>c(H3PO4)>c(HPO42-)
C.c(H-)+c(Na-)=c(OH)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(H3PO4)
D.c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4)
③假设在25℃时测得0.1mol•L-1Na3PO4溶液的pH=12,近似计算出Na3PO4第一步水解的水解常数(用Kh表示) Kh=1.1×10 -3mol•L-1(忽略Na3PO4第二、第三步水解,结果保留两位有效数字).
(1)甲同学用图l所示装置(部分夹持装置略)探究NO与Na2O2的反应.

查阅资料:
2NO+Na2O2═2NaNO2
6NaNO2+3H2SO4═3Na2SO4+2HNO3+4NO↑+2H2O
酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2-
①A中反应的化学方程式是Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O.B中观察到的主要现象是铜片逐渐溶解,溶液变为蓝色,有无色气泡产生,F装置的作用是吸收未反应的NO.
②在反应前,打开弹簧夹,通入一段时间N2,目的是将装置中的空气排净.
③充分反应后,检验D装置中发生反应的实验是取D装置中是产物少许于试管中,加稀硫酸,若产生无色气体,遇到空气变为红棕色,则产物为亚硝酸钠.
(2)乙同学查阅有关弱酸的电离平衡常数:
| 化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×108 | 4.9×10-10 | K1=4.3×10-7 K1=5.6×10-11 |
(3)磷酸(H3PO4)为一种三元酸,其在水溶液中各种存在形式物质的量分数(δ) 随pH的变化曲线如图2:
①Na3PO4溶液中,C(Na+)/c(PO43-)>3(填“>”“=”或“<”).向Na3PO4,溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为HPO42-+H+=H2PO4-.
②由图推断NaH2PO4溶液中各种微粒浓度关系是AD.(填选项字母)
A.c(Na-)>c(H2PO4-)>c(H+)>c(HPO42-)>c(H3PO4)
B.c(Na+)>c(H2PO4-)>c(OH-)>c(H3PO4)>c(HPO42-)
C.c(H-)+c(Na-)=c(OH)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(H3PO4)
D.c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4)
③假设在25℃时测得0.1mol•L-1Na3PO4溶液的pH=12,近似计算出Na3PO4第一步水解的水解常数(用Kh表示) Kh=1.1×10 -3mol•L-1(忽略Na3PO4第二、第三步水解,结果保留两位有效数字).
18.化学与人类生活、生产和社会可持续发展密切相关,下列说法正确的是( )
| A. | “地沟油”可以生产“生物燃料”,生物燃料本质上能量来源于太阳能 | |
| B. | 消除水体中的HgCl2污染可利用微生物使其转化为有机汞CH3HgCl | |
| C. | 人体内没有能使纤维素水解成葡萄糖的酶,但可以加强胃肠蠕动,有助于消化,因此纤维素是人类的营养食物 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是经提纯的二氧化硅 |
15.25℃时,有关弱酸的电离常数如下:
下列说法中正确的是( )
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | a mol•L-1HCN溶液与b mol•L-1NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b | |
| C. | HCN与Na2S溶液一定不能发生反应 | |
| D. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
16.青藤碱具有驱风寒湿、活血止痛的功效,其结构简式如图所示,下列说法正确的是( )
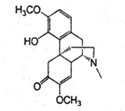

| A. | 每个青藤碱分子中含有2个手性碳原子 | |
| B. | 1mol最多能与1molBr2发生反应 | |
| C. | 1mol最多能与4molH2发生反应 | |
| D. | 青藤碱既能与盐酸反应又能与NaOH溶液反应 |
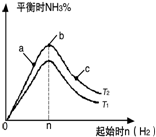 在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;
在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;